营养与健康所揭示内皮细胞程序性坏死介导全身系统性炎症致死机制
近日,《细胞与分子免疫学》(Cellular & Molecular Immunology)在线发表了中国科学院上海营养与健康研究所章海兵课题组完成的题为MLKL-mediated endothelial necroptosis drives vascular damage and mortality in systemic inflammatory response syndrome的研究成果。研究发现,在全身炎症反应综合征(SIRS)病理进程中,血管内皮细胞的程序性坏死介导血管内皮完整性的破坏和血管损伤,最终诱导多器官衰竭与个体死亡。这一成果为SIRS患者的治疗提供了新的药物靶标与理论依据。
细胞因子的过度分泌会引发危及生命的全身炎症反应综合征,并表现为败血症或细胞因子风暴。然而,SIRS诱导多器官功能障碍综合征并最终导致死亡的机制尚未明确,拯救SIRS患者生命的单一疗法尚未出现。虽然凝血功能障碍和细胞程序性坏死被认为是SIRS病理进程中的关键因素,但两者之间的相互作用机制以及具体发生细胞程序性坏死的细胞类型仍不清楚。因此,亟需解析SIRS的病理机制。
该研究利用活体显微镜的可视化分析等实验证明,抗凝血肝素和非抗凝血肝素预处理均可以保护小鼠免受TNF-α诱导的SIRS致死。同时,在TNF-α诱导的SIRS中,细胞程序性坏死关键蛋白MLKL或RIPK3的缺失使得凝血减少和死亡率下降,而RIPK3激酶区域突变鼠Ripk3Δ/Δ和RHIM结构域突变鼠Ripk3V448P/V448P对于TNF-α诱导的低温症和致死具有抵抗效果。这表明,在SIRS相关致死进程中,细胞程序性坏死在凝血上游发挥重要作用。进一步,该研究通过遗传谱系追踪小鼠模型Tie2-Cre;Rosa26-tdT,通过追踪内皮细胞揭示内皮细胞坏死是TNF-α诱导SIRS模型中小鼠血管损伤的关键因素,通过构建内皮细胞Mlkl特异性敲除小鼠Mlklflox/flox;Tie2-Cre。研究发现,阻断内皮细胞程序性坏死能够保护血管内皮的完整性,从而改善TNF-α诱导的SIRS低温症和致死率。
该研究利用双光子显微镜活体成像并构建多种遗传小鼠模型,揭示了内皮细胞RIPK3-MLKL信号轴介导的细胞程序性坏死破坏血管内皮的完整性,致使血管损伤并介导凝血功能障碍和多器官衰竭的发生,最终导致SIRS患者死亡的病理机制。这提示靶向血管内皮细胞程序性坏死治疗SIRS患者的策略具有潜在临床应用价值。
研究工作得到国家重点研发计划和国家自然科学基金等的资助,并获得营养与健康所所级公共技术中心分析测试技术平台和实验动物技术平台的支持。
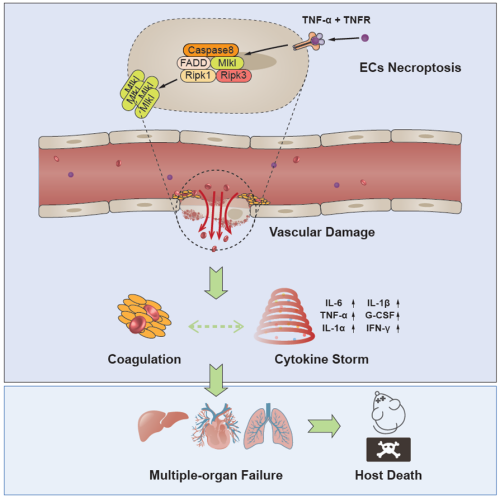
血管内皮细胞坏死在SIRS诱导多器官衰竭及个体死亡中的关键作用
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...