山东大学荀鲁盈/夏永振教授团队在氧化胁迫诱导蛋白质谷胱甘肽化修饰领域取得新进展
近日,山东大学微生物改造技术全国重点实验室荀鲁盈/夏永振教授团队在氧化胁迫诱导蛋白质谷胱甘肽化修饰领域取得新进展,在氧化还原生物学知名期刊Redox Biology发表了题为”Oxidants induce Escherichia coli MarR glutathionylation in the presence of glutathione”的研究论文。博士后王天琪为论文第一作者,荀鲁盈教授和夏永振教授为共同通讯作者,山东大学微生物改造技术全国重点实验室为第一完成单位和通讯作者单位。
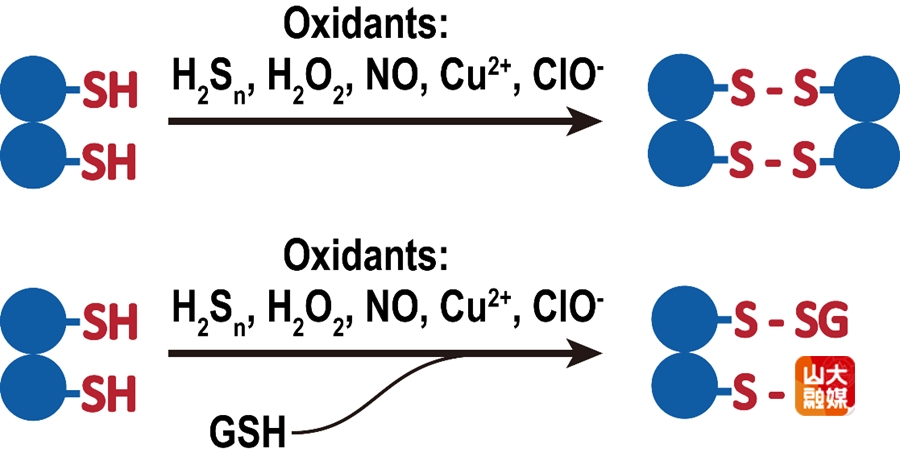
图1. MarR在暴露于氧化剂后形成四聚体,但在GSH存在的条件下会发生谷胱甘肽化修饰
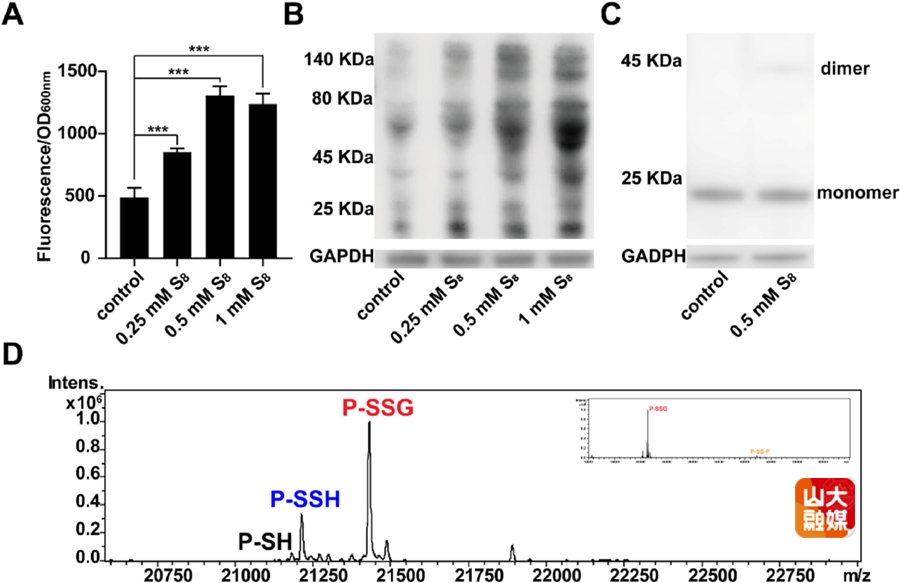
图2. 大肠杆菌在暴露于S₈后MarR蛋白发生谷胱甘肽化修饰
蛋白质巯基(-SH)的氧化修饰对细胞功能调控至关重要。以往认为,大肠杆菌中的多重抗药性蛋白家族的转录调控因子MarR在氧化剂作用下形成二硫键四聚体,降低与DNA的结合能力,但未考虑细胞内高浓度谷胱甘肽(GSH,约1-10 mM)的影响。团队首次系统揭示,GSH存在时,五种氧化剂(S₈、Cu²⁺、H₂O₂、ClO⁻、NO供体)诱导MarR蛋白主要发生谷胱甘肽化(P-SSG),而非四聚体化 (图1)。分子动力学模拟和凝胶阻滞实验实验显示,谷胱甘肽化显著削弱了MarR与DNA的结合亲和力,促进下游基因表达;而GSH缺乏时则以四聚体为主。进一步的胞内实验显示(图2),S₈处理大肠杆菌后,荧光报告系统表达上升,MarR蛋白以谷胱甘肽化为主(72%),并伴少量过硫化(24%)和未修饰(4%)状态,细胞中蛋白总体谷胱甘肽化水平也显著提高。
团队通过多种实验方法证实了S₈诱导MarR蛋白谷胱甘肽化的现象。如图所示,当携带报告质粒的大肠杆菌暴露于不同浓度的S₈后,荧光蛋白mKate表达水平显著上升,表明MarR对下游基因的抑制作用被解除(A);通过Western blot分析和抗GSH抗体检测发现,细胞内蛋白质谷胱甘肽化水平整体增加(B);通过抗His标签抗体特异性检测发现,MarR5XS蛋白在S₈处理后以单体和少量二聚体形式存在(C);更为关键的是,LC-MS质谱分析直接证实了从处理后细胞中纯化的MarR5XS蛋白主要以谷胱甘肽化形式(72.2%)存在,并伴有少量过硫化形式(23.7%)和未修饰形式(4.1%)(D)。
研究还进一步推测了S₈诱导MarR谷胱甘肽化的四种可能途径:1) S₈与GSH反应生成GSSG修饰MarR;2) 生成过硫化谷胱甘肽(GSSH)修饰MarR;3) MarR先被S₈过硫化,再与GSH反应;4) MarR四聚体中的二硫键被GSH还原。
S₈是一种相对稳定的硫烷硫形式。硫烷硫在微生物代谢中具有重要作用,一般包含无机过/多硫化物(H2Sn)、有机过/多硫化物(如GSnH)和S₈等。团队前期已证实S₈可被微生物吸收并转化为多种活性硫烷硫形式。本研究首次建立了蛋白谷胱甘肽化与胞内硫烷硫水平的直接关联,提出硫烷硫诱导谷胱甘肽化是细胞应对氧化应激的重要机制。研究同时强调,蛋白巯基氧化修饰研究需重视GSH的影响。这不仅为理解氧化胁迫下蛋白功能调控提供新视角,也为硫烷硫信号分子调控蛋白功能的研究提供理论基础。
该研究得到了国家重点研发计划项目、国家自然科学基金和山东省自然科学基金项目等资助。团队此前已在S₈及硫烷硫生理生化领域取得多项重要成果(AEM, 2021; STOTEN, 2023, 2024; Antioxidants, 2022),包括揭示S₈在异养细菌中的合成、代谢和穿膜传递机制,这为探究硫烷硫信号分子研究打下坚实基础。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...