浙江大学医学院徐浩新教授团队鉴定了一种非经典的溶酶体氢离子泄露途径的分子基础——SLC7A11,并揭示了此通路参与溶酶体和细胞功能调控的机制,以及其在神经退行性疾病的病理进程的关键作用。该成果以“SLC7A11 is an unconventional H+ transporter in lysosomes”为题,于北京时间2025年4月24日发表在《Cell》,徐浩新和浙江大学医学院胡美钦研究员为共同通讯作者,浙江大学医学院博士生周南、陈静芝、胡美钦为共同第一作者。

氢离子释放还有“新出口”?
溶酶体是细胞的“废物回收中心”,通过自噬过程将细胞自身受损细胞器等“垃圾”降解再利用。溶酶体内部保持着pH 4.5-5.0的酸性环境,还含有多种帮助降解“垃圾”的酸性水解酶,其内部过酸或过碱都会显著抑制其中酸性水解酶的活性,导致细胞内降解底物堆积和自噬受阻。而溶酶体功能障碍与帕金森病、阿尔兹海默病等神经退行性疾病密切相关。
为了维持适宜的酸性环境,溶酶体膜上的氢离子泵V-ATPase会源源不断地从细胞质向溶酶体“泵入”氢离子。“溶酶体内部的稳态依赖于‘一进一出’的平衡,好比水库保持水位,有进水泵,还得配出水闸,溶酶体膜上也应该有相应的离子通道介导氢离子流出。”徐浩新说,团队曾在2022年鉴定出溶酶体首个氢离子通道TMEM175。其在溶酶体环境过酸时被激活,介导快速的氢离子外流,是一条氢离子释放的“紧急快速出口”。
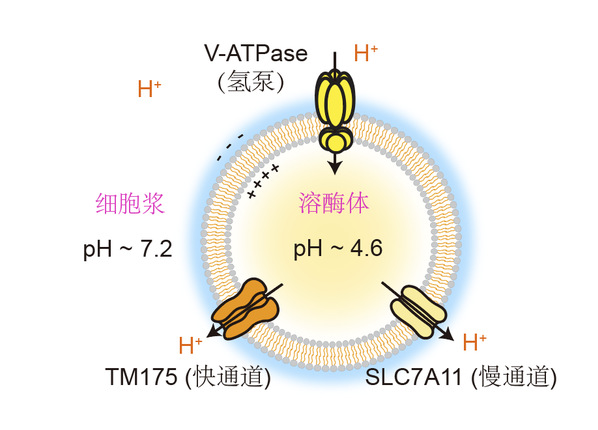
溶酶体酸性稳态的维持机制
然而,团队发现,当同时敲除细胞中氢离子通道TMEM175,且抑制氢离子泵V-ATPase的作用,即已知的氢离子“进、出口”都关闭时,溶酶体依然逐渐碱化,“这说明仍有氢离子泄漏或者释放途径还没被发现。”胡美钦说。
于是,团队开始寻找这个氢离子“慢出口”。
坚定自己的判断
为了寻找这个未知的路径,团队基于大量公开发表的溶酶体蛋白质组学数据,构建了包括约60种溶酶体膜蛋白的OLMP敲除细胞文库,从中筛选出了去酸化的关键蛋白——SLC7A11。
“在检测SLC7A11介导的离子转运时,我们先尝试使用了团队的独门绝技——溶酶体膜片钳技术,但没有记录到明显的电流。”周南说,团队猜测可能是SLC7A11作为转运蛋白(转运速率远低于通道蛋白)介导的离子流动低于膜片钳方法的检测限。于是,团队重新探索实验方案,通过特异性分离纯化溶酶体,再采用成像实验,观测到了较慢速的离子流动,开发出一套新的监测方法。

与此同时,小分子化合物库高通量筛选实验也找到了对溶酶体酸性有显著增强的小分子——Erastin。Erastin是铁死亡的常用诱导剂,其作用靶点正是SLC7A11。
“在以往的研究和报道中,研究者们认为SLC7A11主要定位于细胞膜上。” 陈静芝说,在超分辨荧光显微镜下,团队却清晰地看到大量定位在溶酶体膜上的细胞内的信号。
面对这个实际与前人经验之间的矛盾,团队坚定自己的判断,又设计了大量实验,确认了SLC7A11主要在溶酶体上定位,并通过顺浓度梯度排出胱氨酸并摄入谷氨酸发挥其氢离子流出、酸性调节功能。
谷氨酸作为酸性氨基酸,其侧链pKa约为4.3,在溶酶体酸性环境中以质子化形式存在,但其在细胞浆中性环境中以质子解离形式存在。“溶酶体跨膜转运会不断通过其质子化/氢离子解离形式向胞质持续运输氢离子,因此是一种非典型的溶酶体氢离子泄漏通路。”胡美钦说,该研究也填补并拓展了领域内关于溶酶体上SLC7A11蛋白的研究空缺。
疾病治疗的新希望
此外,团队发现,SLC7A11失活后的溶酶体过度酸化,导致水解酶活性显著下降和大量待降解底物的堆积。在神经元中表现为病理性α-突触核蛋白的聚集。“这些结果在一位携带有SLC7A11突变的早发帕金森病病人的细胞模型上得到了验证。”胡美钦说,SLC7A11作为帕金森病新的风险基因,未来可能用于疾病的早筛和新治疗方案的开发。

“我们采用低浓度小分子药物氯喹将过酸化的溶酶体pH值修正到正常范围后,意外地发现铁死亡进程得到有效抑制。”周南说,“这提示溶酶体酸碱失衡可能是铁死亡的关键诱因。”
“SLC7A11介导的溶酶体慢速氢离子泄漏途径,结合我们此前发现的TMEM175介导的溶酶体快速氢离子释放途径,‘一慢一快’与氢离子泵V-ATPase形成了溶酶体酸碱平衡调控的逻辑闭环。”徐浩新说,这为团队的研究补上了一块空缺。
DOI: 10.1016/j.cell.2025.04.004
(文 查蒙/图 哲映 部分由课题组提供)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...