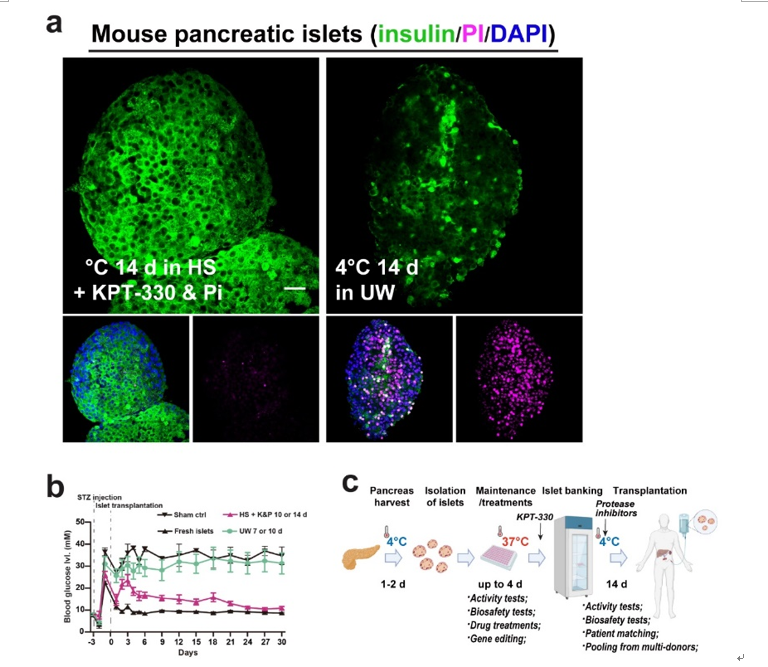
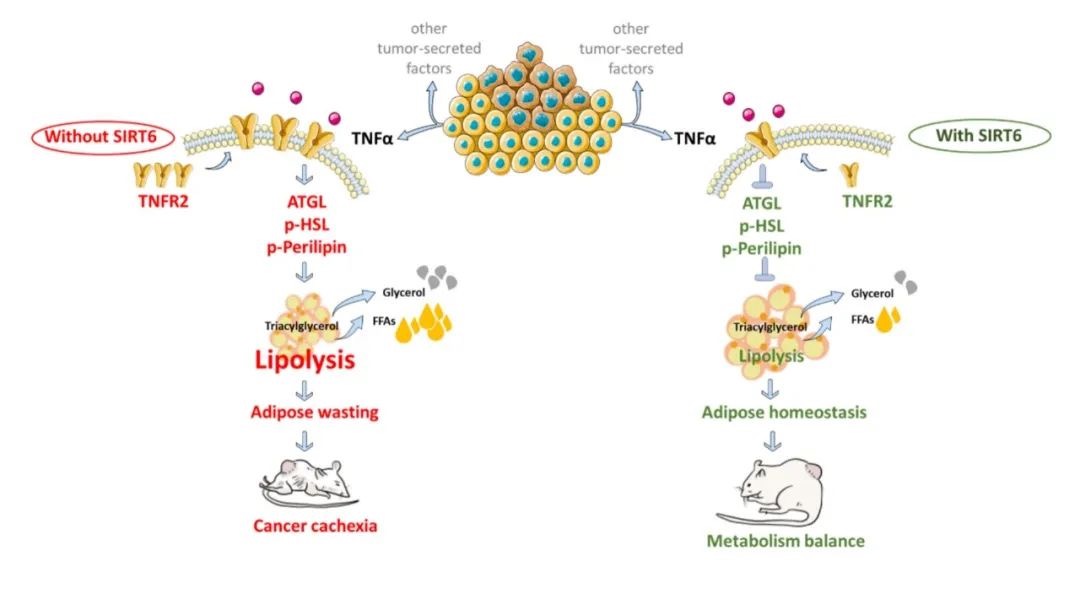
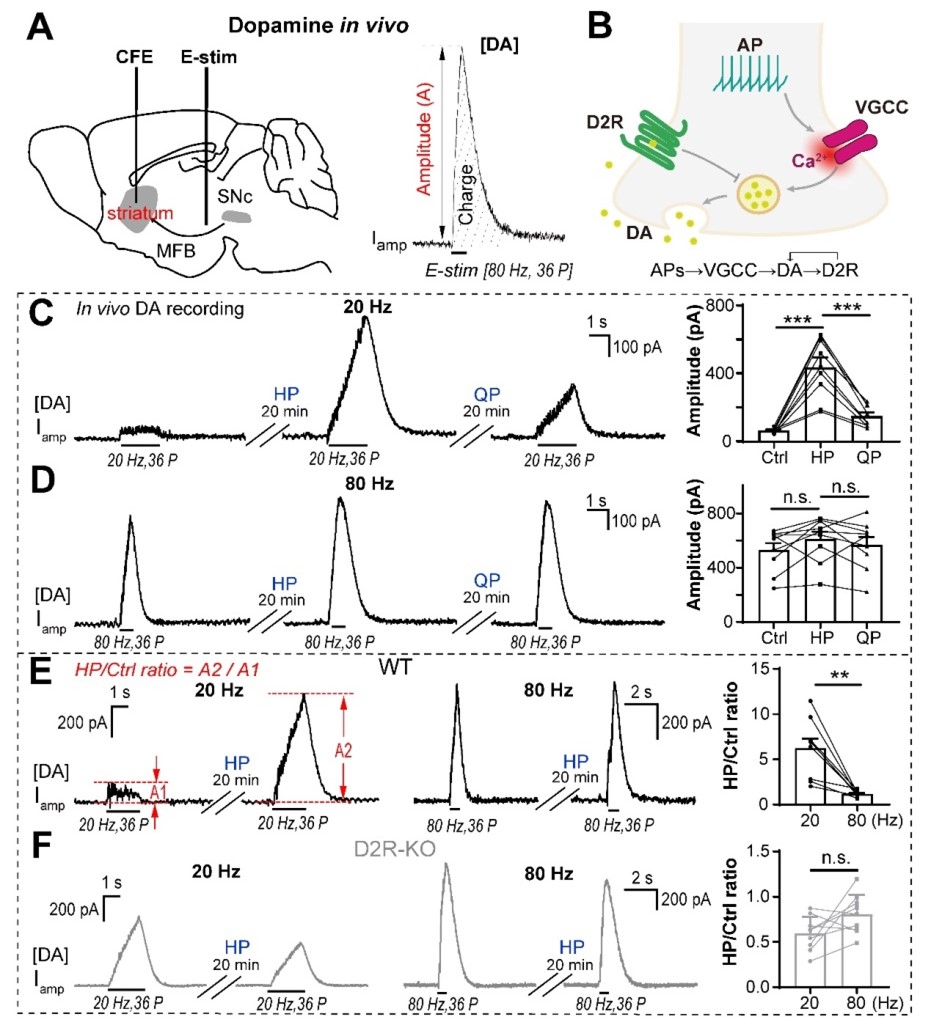
免疫系统能够通过代谢重编程灵活应对内外环境的压力与刺激。巨噬细胞作为天然免疫系统的重要组成部分,在执行免疫功能时高度依赖特定的代谢重编程。尽管越来越多的研究提示某些代谢改变可能会影响巨噬细胞的功能,但是对于巨噬细胞如何选择和重编程关键的代谢反应,以及其如何感知这些代谢变化以响应环境压力刺激,人们仍然知之甚少。
4月18日,清华大学生命学院江鹏课题组在《自然·微生物学》(Nature Microbiology)上发表题为“巨噬细胞代谢重塑天冬氨酸-精氨基代琥珀酸支路产生延胡索酸以抵御病毒”(Metaboli cremodelling produces fumarate via the aspartate–argininosuccinateshunt in macrophages as an antiviraldefence)的研究论文,揭示了早期病毒感染诱导的由ASS1驱动的AAS旁路是巨噬细胞中延胡索酸的重要来源,明确了其在调控抗病毒先天免疫中的关键作用,为代谢干预调节免疫功能提供了潜在靶点。
此前,江鹏课题组发现了尿素循环代谢异常决定肿瘤和巨噬细胞的命运,并系统研究了TCA cycle代谢在抗肿瘤和免疫调控中的作用。研究人员发现,病毒感染早期可促使巨噬细胞中的尿素循环与三羧酸(TCA)循环发生协同重编程,形成一个闭环的代谢通路,称为天冬氨酸–精氨基代琥珀酸(Aspartate–Argininosuccinate, AAS)旁路。研究通过RNA测序、非靶向代谢组学分析和同位素示踪等手段,证实该旁路由胞质中的精氨基代琥珀酸合成酶(ASS1)驱动,进而促进延胡索酸(fumarate)生成,并增强炎症信号传导。功能实验表明,敲除ASS1会显著降低细胞内延胡索酸水平,抑制干扰素-β(IFN-β)的表达,并削弱线粒体呼吸功能。更为关键的是,病毒感染或外源性补充延胡索酸酯可通过促进线粒体抗病毒信号蛋白(MAVS)琥珀酸化,激活视黄酸诱导基因-I样受体(RIG-I-like receptor)信号通路,从而增强IFN-β的表达。这一机制不仅在囊泡性口炎病毒(VSV)感染模型中得到验证,也同样适用于仙台病毒和甲型流感病毒等其他病毒感染。此外,感染埃博拉病毒患者的单核细胞呈现ASS1表达上调。ASS1缺失的小鼠在VSV感染后则显现出干扰素应答受损的表型。

病毒感染诱导的代谢重编程合成延胡索酸提高抗病毒天然免疫反应
清华大学生命学院夏文君博士后、毛优翔博士后和2023级博士生夏子言为论文共同第一作者,江鹏副教授为论文通讯作者。研究得到清华大学生命学院副教授王海峰、基础医学院教授程功、药学院副教授张从刚,北京大学基础医学院研究员游富平的大力支持。研究得到国家自然科学基金、清华-北大生命科学联合中心和博士后科学基金的经费支持,以及清华大学动物中心、代谢平台和流式分选平台的大力支持。
论文链接:
https://www.nature.com/articles/s41564-025-01985-x
供稿:生命学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...