山东大学Molecular Cell!孙金鹏/杨帆/阿拉坦高勒/于晓/夏明团队揭示人源G蛋白偶联受体质子感知及偏好性信号转导的分子机制
4月10日,山东大学孙金鹏教授团队、内蒙古大学阿拉坦高勒教授团队,山东大学于晓教授团队联合山东第一医科大学夏明教授团队,在Molecular Cell在线发表题为“Structural basis and biased signaling of proton sensation by GPCRs mediated by extracellular histidine rearrangement”的研究论文(Molecular Cell配发同期专题评述)。该研究综合运用了药理学、计算生物学及生化实验方法等多种手段,系统解析了两种人源质子感知受体GPR4和GPR68的质子感知,信号传递、及下游偏好性信号通路激活过程中的分子机制,为靶向质子感知GPCRs的临床药物开发提供了重要的理论依据。
山东大学高等医学研究院研究员郭璐璐、副研究员朱孔凯,山东大学基础医学院博士研究生钟亚妮、高明新,内蒙古大学博士研究生齐志敏,中南大学湘雅医院博士研究生刘俊彦和山东大学基础医学院硕士研究生刘梓立为本文的共同第一作者;山东大学基础医学院/高等医学研究院教授孙金鹏,山东大学基础医学院教授杨帆、于晓,内蒙古大学教授高阿拉坦高勒,山东第一医科大学教授夏明为本论文共同通讯作者。山东大学为第一作者单位和通讯作者单位。
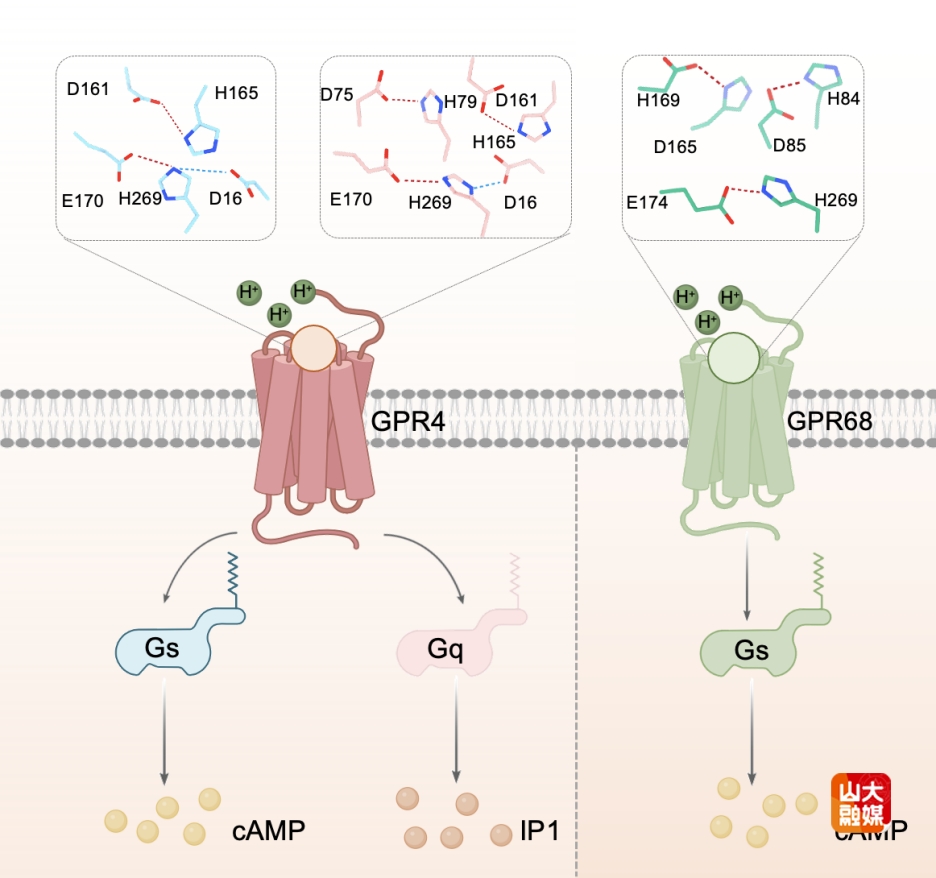
质子(Proton)是一种带正电的小粒子,广泛存在于自然界。在生物体内,质子通常以氢离子(H⁺)的形式参与了多种关键的生物化学反应,尤其在维持体内酸碱平衡中发挥核心作用。人体通过精密的生理机制将血液pH稳定维持在7.32至7.42之间,这一平衡主要依赖于呼吸系统调节二氧化碳的排出以及肾脏对氢离子的分泌与重吸收功能。在这一过程中,G蛋白偶联受体(G protein–coupled receptors, GPCRs)家族成员GPR4/GPR68发挥了关键作用。GPR4在脑干的后锥体核(retrotrapezoid nucleus, RTN)中高度表达,能够感知局部质子浓度的变化,从而监测血液中二氧化碳水平,并通过激活Gs和Gq信号通路调节呼吸节律和通气反应;在肾脏,GPR4则通过感应酸性微环境调节肾单位的酸排泄功能,进一步维持全身pH的稳态。
除了在生理稳态调控中的作用外,GPR68与GPR4还参与多种病理生理过程,特别是在骨骼发育和肿瘤发生发展中发挥重要功能。例如,GPR68可在成骨细胞中通过Gq通路促进IP₃的积累,从而调节局部pH并维持骨组织功能。越来越多的研究表明,这些受体在肿瘤细胞的增殖、迁移及其对肿瘤微环境的适应中也发挥着重要作用。本次研究关注人源质子感知受体GPR4和GPR68是如何识别质子并选择性地激活偏好性下游信号通路的分子机制,与人类正常生理调节和对酸碱环境的感知密切相关,也为深入理解pH感知在一些疾病发展过程中所起的作用奠定基础。
研究者首先通过生化及药理学实验,在不同pH条件下系统评估了GPR4和GPR68的激活特性,发现GPR4的Gs信号通路的最适激活pH为7.2-6.8,而GPR68的Gs信号通路在更酸性的pH 6.0-5.6范围内表现出最强活性。在此基础上,研究者进一步解析了GPR4和GPR68在不同pH条件下与Gs或Gq三聚体高分辨率冷冻电镜结构。结合基于结构的pKa预测、pH依赖的活性测定、分子动力学模拟以及突变功能验证,研究者发现两个保守的胞外组氨酸残基——ECL2区域的H165ECL2-45.47×47和TM6上的H2697.36。在质子化后,这两个残基分别与D161ECL2-45.43和E170ECL2-45.52等氨基酸形成极性相互作用网络,诱导ECL2与TM6之间发生构象重排。上述变化构成了GPR4和GPR68在质子诱导激活中的共性机制。首次从原子分辨率水平明确揭示了关键组氨酸的质子化所驱动的的特异性构象变化及其在极性网络重塑与受体激活中的核心功能。进一步分析表明,GPR68中存在一个额外的质子感知位点H842.67,其质子化后可与D85ECL–23.48×48形成极性作用,增强TM2、ECL1和ECL2之间的相互作用。这一特征可能是GPR68在更酸性环境中依然保持高活性的分子基础。此外,研究者还发现,不同组氨酸残基的质子化状态会影响受体与不同G蛋白亚型的选择性偶联。例如,H792.66的质子化能够专一性地促进GPR4与Gq的偶联,而对其与Gs的结合无显著影响。这一发现打破了传统对GPCR质子感知机制的认知,揭示了特定质子感知位点对G蛋白亚型选择性偶联的决定性作用,从而影响下游信号通路的特异性功能输出。最后,研究者通过结构比对发现了由多个疏水残基构成的“疏水传导链”作为信号传递路径,连接质子感知位点至构象“开关”残基F6.48。并利用突变实验证实了该信号通路在质子感知信号转导中的功能性作用。
本研究得到国家自然科学基金项目、国家杰出青年科学基金项目、国家自然科学基金国家重点项目、国家重点研发计划项目等基金支持。
孙金鹏教授团队长期从事膜受体GPCR的细胞信号转导和微观环境药理学研究,在GPCR对痒觉,嗅觉,味觉,听觉、机械力等感觉的感知机制中取得了系列成果:揭示了痒觉受体的内源性配体和独特的激活模式(Nature.2021;600(7887):164-169);解析了嗅觉受体对气味的感知机制(Nature. 2023 Jun;618(7963):193-200);发现了黏附类受体LPHN2在毛细胞表达,参与了听觉和平衡的调控,是平衡所必须的,为眩晕和听力障碍的治疗提供潜在的新的治疗途径(Cell Res. 2025 Apr;35(4):243-264)。揭示了G蛋白偶联受体(GPR4)对酸碱环境的感知和演化机制(Cell. 2025 Feb 6;188(3):653-670)。阐明了黏附类受体对力的感知机制并发展了多肽激动剂和拮抗剂(Nature. 2022a 604(7907):771-778; Nature. 2022b 604(7907):763-770)。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...