早期胚胎心脏主要由心内膜组织及心肌组织构成。其中,心内膜分布于的心脏内表面,面积广大,与心肌小梁紧密相连,对心肌小梁致密化发育发挥重要的调控作用。心内膜发育异常会引起心肌小梁发育缺陷,导致心肌致密化不全、心肌变薄及心功能不全,严重者导致心力衰竭,危及个体发育及生存。目前已知Notch信号在心内膜发育过程中起到非常重要的调控作用,但在细胞器水平对心内膜发育的认识则知之甚少。
澳大利亚南威尔士大学杨洪远与河北医科大学高明明实验室制作了甘油三酯合成的限速酶之一甘油-3-磷酸酰基转移酶4(GPAT4)的全身敲除小鼠,发现胚胎致死及心脏发育异常。他们与南京大学医学院杨中州团队开展合作研究,探讨GPAT4调控心脏发育的机制。为此,杨中州团队培育出了内皮细胞敲除(Tie2-Cre介导)及心内膜细胞敲除(Nfatc1-Cre介导)Gpat4的小鼠,发现GPAT4功能缺失导致心内膜发育异常并进而影响到心肌发育,明确了GPAT4对心内膜发育的特异调控功能。之后,他们利用全身及内皮细胞敲除小鼠的心脏组织,进行基因表达谱分析,发现cGAS-STING及一型干扰素反应通路被激活,该通路的过度激活会引发细胞凋亡。进而,他们发现心内膜细胞GPAT4功能缺失导致内质网应激,引起内质网-线粒体接触及通讯增加,钙离子由内质网进入线粒体,导致线粒体钙超载,线粒体被破坏,其中的DNA逃逸至线粒体外,激活cGAS-STING及一型干扰素反应,最终导致心内膜发育受损,心肌小梁致密化出现障碍,心肌及心脏发育出现异常,导致胚胎致死。
GPAT4位于内质网膜上。他们通过AlphaFold3(AF3)预测和蛋白互作实验,发现GPAT4通过与PERK竞争结合eIF2a,维持心内膜细胞的内质网稳态。GPAT4功能缺失导致内质网稳态被破坏,激活内质网应激反应。利用化合物及遗传学方法对内质网应激反应、线粒体钙超载及cGAS-STING-一型干扰素反应进行抑制后,可以改善GPAT4功能缺失小鼠的心内膜及心肌发育受损。
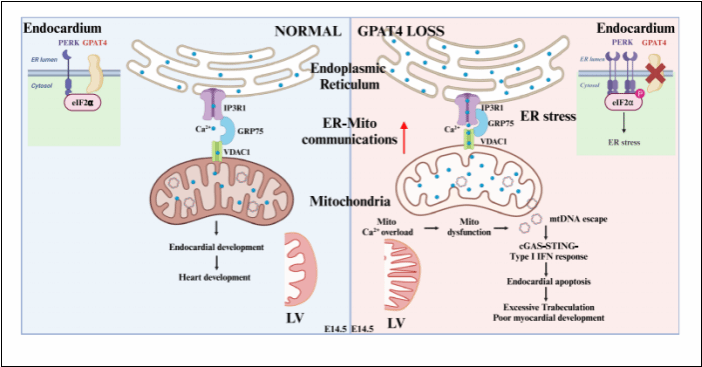
上述研究结果于近期发表于Nature Communications杂志,题目为“GPAT4 sustains endoplasmic reticulum homeostasis in endocardial cells and safeguards heart development”。该研究发现内质网稳态及内质网-线粒体互作对心内膜发育的重要调控作用,在细胞器水平帮助理解心肌致密化不全的发生机理。
南京大学博士研究生赵天阳及河北医科大学硕士研究生金魁培为本文共同第一作者。南京大学杨中州教授及罗文教授、澳大利亚南威尔士大学杨洪远教授(现德克萨斯大学休斯顿健康科学中心)为共同通讯作者。该项研究得到苏州大学苏雄教授、浙江大学佟超教授及北京师范大学王友军教授的帮助,并得到国家自然科学基金委与科技部重点研发专项以及江苏省研究生科研与实践创新计划项目的基金支持。

© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...