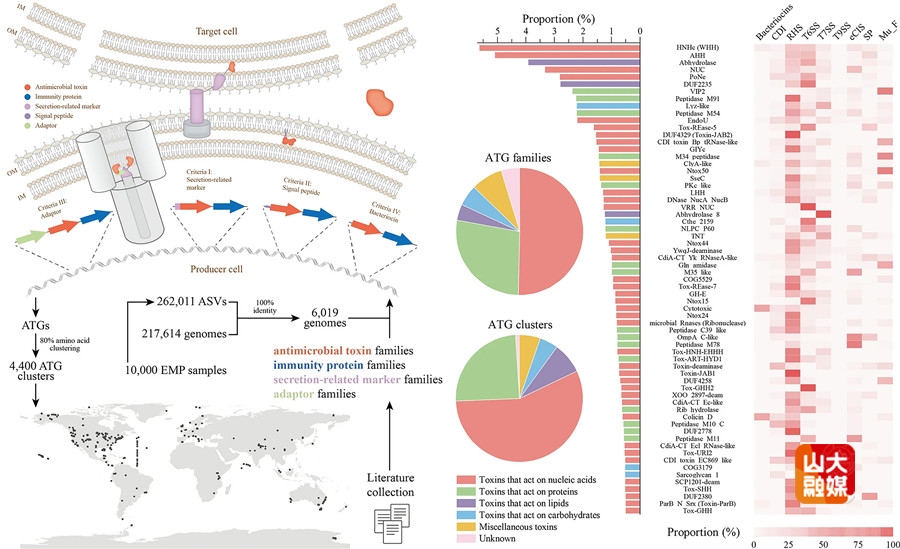
中山大学王金凯团队阐明肿瘤细胞中激酶通过METTL3乙酰化逃避铁死亡的新机制
(通讯员王金凯)增强子和启动子区域通常是H3K27ac组蛋白乙酰化所标记的区域,而p300是负责催化H3K27ac的乙酰转移酶。近年研究表明,新生RNA还在染色质上的时候甲基转移酶就开始添加m6A修饰,而增强子RNA(eRNA)和启动子RNA(paRNA)也能够被m6A修饰并参与基因的转录调控,然而这些RNA的m6A修饰如何被选择性地调控并不清楚。
2025年3月17日,中山医学院王金凯教授课题组在《Molecular Cell》上发表了题为“Spatial control of m6A deposition on enhancer and promoter RNAs through co-acetylation of METTL3 and H3K27 on chromatin”的研究论文。该工作发现p300主要在H3K27ac染色质上催化METTL3乙酰化,从而抑制METTL3与METTL14的结合使METTL3脱离H3K27ac染色质,因此特异性地降低增强子RNA(eRNA)和启动子RNA(paRNA)的m6A修饰水平促进铁死亡抑制基因的表达。在肿瘤细胞中高表达的激酶PAK2能够通过磷酸化METTL3而促进METTL3的乙酰化,从而抑制肿瘤细胞铁死亡的发生(如图)。
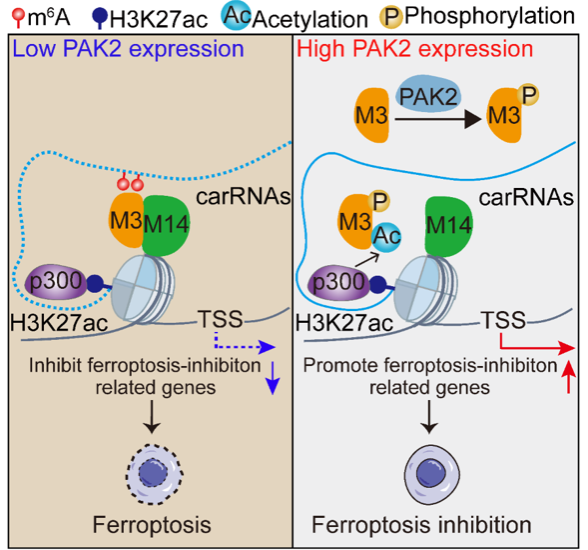
论文所揭示机理的模式图
该研究提出了“co-acetylation” 这一新概念,揭示了一种通过METTL3和H3K27在细胞内特定空间内共同被p300催化发生乙酰化的方式从而产生交互作用,并介导在不同染色质区域选择性调控m6A的新机制,阐明肿瘤细胞中激酶通过METTL3乙酰化逃避铁死亡的新机制,为通过选择性干预m6A治疗肿瘤奠定了基础。
中山大学中山医学院的王金凯教授为本文的通讯作者,其课题组博士后黄翔、已毕业博士研究生张洁(现吉首大学老师)、博士后寸益贤、硕士研究生叶美君、博士后任志军为本文共同第一作者。
全文链接:https://doi.org/10.1016/j.molcel.2025.02.016
文稿终审:郝雅娟
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...