中山大学陈俊团队报道Parkin抑制巨噬细胞抗原递呈促进肿瘤免疫逃逸的机制
(通讯员陈俊)恶性肿瘤的免疫治疗因T细胞浸润不足在实体瘤中受限,而巨噬细胞作为肿瘤微环境的核心组分,其功能调控成为关键突破口。中山大学中山医学院陈俊团队前期发现靶向巨噬细胞免疫检查点(如Siglec-9、SIRPα)可重塑免疫抑制微环境(Nature Cancer, 2023; 2024)。因此,重塑巨噬细胞主导的免疫抑制微环境,将为开发新型免疫联合疗法提供重要突破口。
2025年3月22日,陈俊团队在Science Advances在线发表了题为“AMPK-dependent Parkin activation suppresses macrophage antigen presentation to promote tumor progression”的研究论文。该研究首次揭示了肿瘤相关巨噬细胞(TAMs)中的Parkin通过抑制巨噬细胞提呈抗原促进实体肿瘤免疫逃逸的功能机制,阐明了Parkin分子的新功能。
该研究首先通过构建多种小鼠肿瘤模型,发现Parkin敲除小鼠(Park2-/-)可显著抑制肿瘤生长。进一步进行单细胞转录组测序分析、流式细胞术及TCR测序,并构建了Parkin巨噬细胞条件性敲除小鼠(Park2fl/fl-Lyz2-Cre+/-),该研究发现Parkin 敲除增强了TAMs中MHC-I表达和抗原递呈,进而促进T细胞的活化、TCR扩增、细胞增殖及浸润,从而控制肿瘤进展与复发。通过对机制的探索,研究者构建了Parkin蛋白点突变的巨噬细胞及巨噬细胞自噬缺陷的条件性敲除小鼠(Atg5fl/fl-Lyz2-Cre+/-),明确了TAMs中AMPK 激活Parkin的E3泛素连接酶活性,调控ATG5依赖性的自噬作用下调巨噬细胞 MHC-I的表达,导致呈递肿瘤抗原不足,削弱了抗肿瘤免疫反应。
治疗策略方面,该研究发现Parkin敲除的巨噬细胞过继回输可抑制免疫缺陷小鼠的肿瘤进展,表明其独立于T细胞发挥抗肿瘤作用。联合PD-L1单抗治疗可协同增强疗效,提示靶向Parkin的细胞治疗具有转化潜力。该研究为开发基于巨噬细胞抗原提呈的新型免疫疗法提供了理论依据。
综上所述,该研究阐明了AMPK 激活Parkin通过ATG5依赖性的自噬作用下调巨噬细胞 MHC-I的表达,削弱了巨噬细胞对肿瘤抗原呈递,进而抑制了抗肿瘤免疫反应(图1)。揭示了Parkin作为巨噬细胞抗原递呈抑制因子的新功能,其靶向策略能够促进巨噬细胞活化T细胞从而抵抗免疫逃逸。
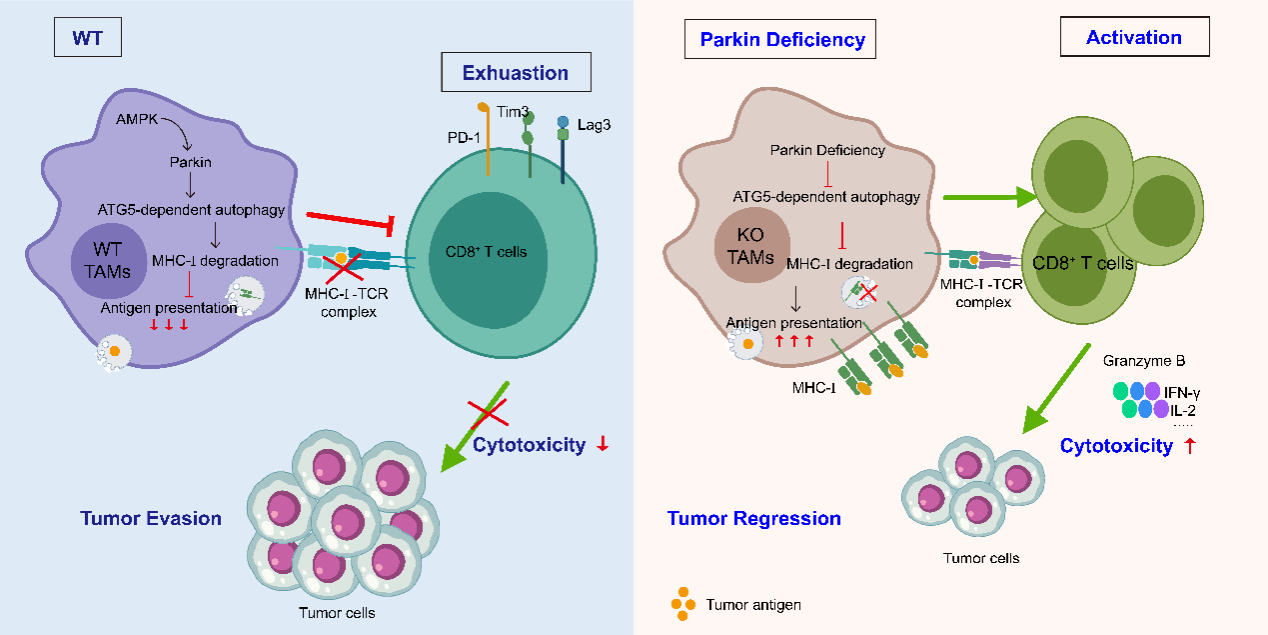
图1. 机制示意图
中山大学中山医学院博士后王馨语、博士毕业生李懿逸为该论文共同第一作者。陈俊教授、广州医科大学廖静教授及博士后王馨语为论文的共同通讯作者。
该研究得到科技部重点研发项目、国家自然科学基金委原创探索项目及面上项目和青年项目、广东省“珠江人才计划”等项目资助。该研究得到中山大学郑利民教授、蔡卫斌教授,四川省肿瘤医院欧娟娟教授,澳大利亚昆士兰大学余迪教授,及加拿大麦吉尔大学Edward Fon教授、Jean-François Trempe教授的大力协助。动物实验依托于中山大学实验动物中心完成。中山大学为论文第一单位。
原文链接:https://www.science.org/doi/10.1126/sciadv.adn8402
文稿终审:郝雅娟
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...