近日,清华大学药学院钱锋课题组研究揭示了抑制补体C3不同表位的补体生物学效应,丰富了补体C3的结构功能关系,为C3抑制剂的合理设计提供了有价值的见解。
补体系统是免疫系统的重要组成部分,通过调理素介导的吞噬作用、免疫调节活性和病原体裂解功能等,在维持组织稳态和免疫监视中发挥关键作用。补体级联反应受多重负调控因子的严格调控,以防止异常活化导致宿主细胞和组织的损伤。补体系统的失调与过度活化已被证实与多种疾病相关,包括阵发性睡眠性血红蛋白尿症(PNH)、湿性年龄相关性黄斑变性(wAMD)以及地图样萎缩(GA)等。
作为血清中含量最高的补体成分,C3是补体级联反应中的核心成分,参与所有补体活性产物(C3a、C3b、C5a、C5b-9)的产生。鉴于C3在补体系统中的核心地位,C3已成为补体相关疾病治疗的重要靶点。目前,EmpaveliTM(聚乙二醇化肽类注射液)和SyfovreTM(玻璃体内注射剂)已分别获批用于治疗PNH和GA,两者的活性成分均为抗C3环肽。此外,目前有十余种C3靶向药物正处于临床前或临床研究阶段。然而,不同C3抑制剂的疗效存在显著差异:Syfovre在GA治疗的III期临床试验中达到主要终点,而C3的单抗NGM621在II期研究中因疗效不足而宣告失败。不同C3抑制剂在临床试验中的显著差异提示,理想的C3抑制剂需以高亲和力结合关键功能表位,C3复杂的结构功能关系是C3药物设计中亟待解决的问题。
该研究中,研究团队首先获得了三种结合C3两种不同表位的C3模型分子(MIs)(图1A)。模型分子MI1/2结合在C3/C3b的MG4/5结构域,而MI3结合在C345C结构域。通过在补体级联反应的不同步骤中加入模型分子(图1B),模型分子产生不同抑制效应。模型分子MI1/2在不同反应步骤中加入均能抑制C3的裂解(图1C和D),而模型分子MI3仅能通过抑制在C3b与FB结合这一步骤产生C3裂解抑制活性(图1E)。
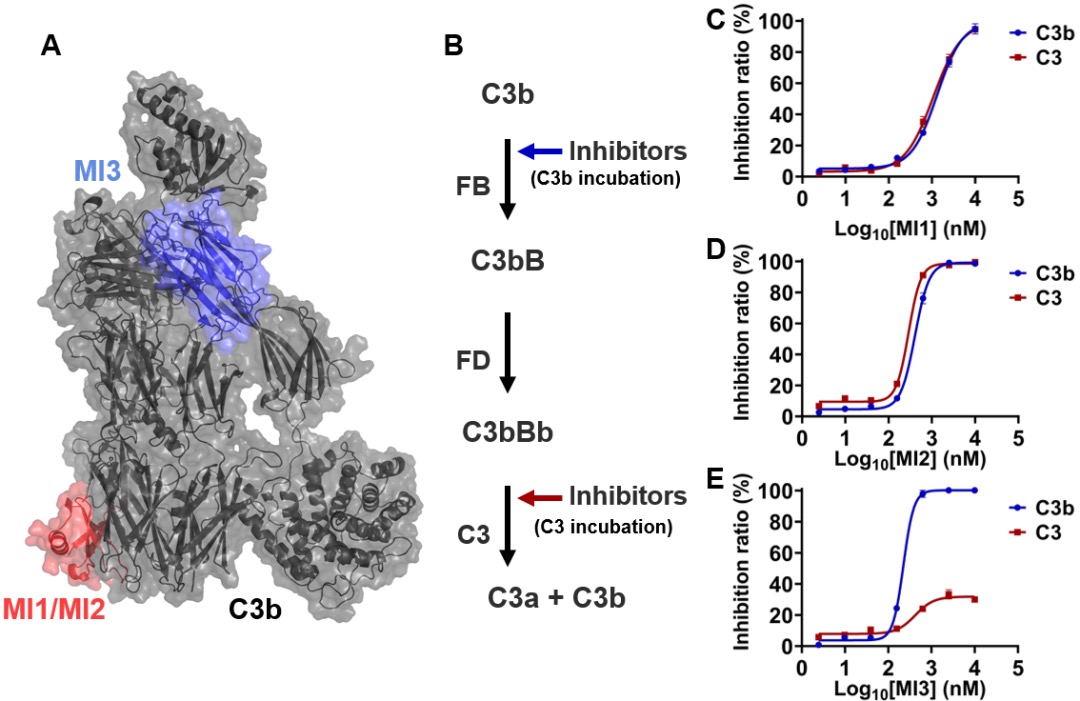
图1.C3模型分子(MIs)的结合表位和抑制机制
结合其他建立的补体抑制活性方法,研究团队证明模型分子MI3通过结合在C345C结构域,抑制C3b与FB、FD结合形成C3转化酶C3bBb,进而产生AP途径偏向性的补体抑制活性;模型分子MI1/2通过结合在MG4/MG5结构域,抑制C3与两种C3转化酶(AP途径:C3bBb;CP途径:C4bC2a)结合进而抑制C3的裂解,在AP和CP两种途径中均有较强的补体抑制活性(图2)。
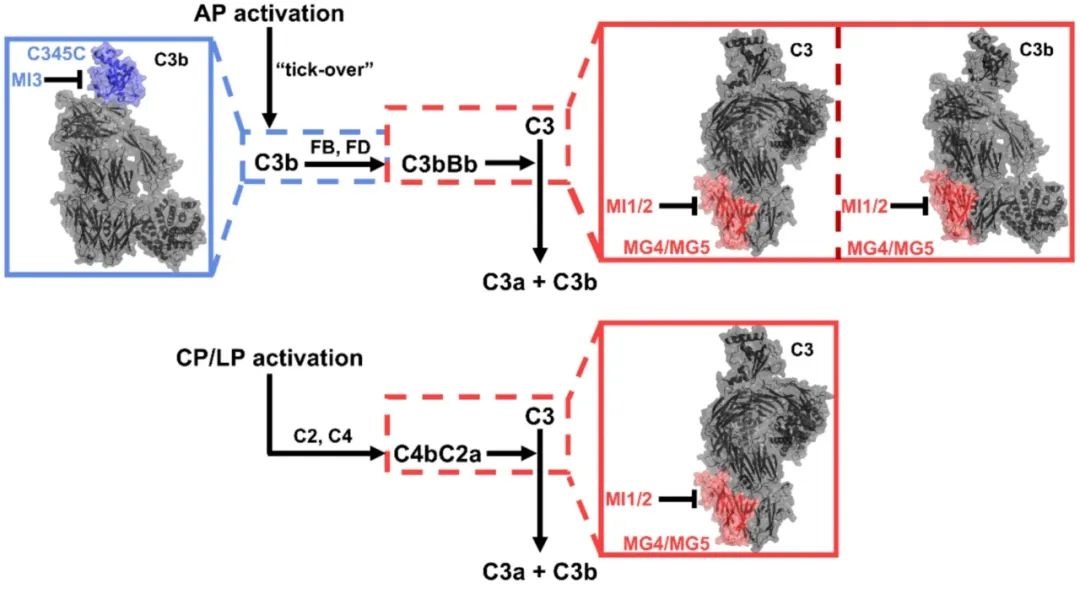
图2.靶向C3中的C345C结构域和MG4/MG5结构域的补体抑制过程
该研究通过三种靶向C3不同表位的模型分子,结合新建立的用于研究补体抑制活性和机制的生化方法,系统解析了C3中两个关键功能表位的结构-功能关系,并通过研究C3表位与补体抑制活性及机制的关系,为开发高效C3靶向治疗药物提供了重要理论依据。
相关研究成果以“针对C3特定表位的抑制以调控补体系统”(Modulating the complement system through epitope-specific inhibition by complement C3 inhibitors)为题,发表于3月的《生物化学杂志》(Journal of Biological Chemistry)。
清华大学药学院钱锋教授、寻济生物科技(北京)有限公司刘慧琴博士为论文共同通讯作者。钱锋课题组2021级博士生陈志栋、寻济生物科技(北京)有限公司王铭爽博士为论文共同第一作者。研究得到北京生物结构前沿研究中心的资助。
论文链接:
https://doi.org/10.1016/j.jbc.2025.108250
供稿:药学院
编辑:李华山
审核:郭玲
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...