山东大学材料学院蒋妍彦课题组在纳米酶抗肿瘤领域取得新进展

近日,材料科学与工程学院蒋妍彦教授团队联合医学融合与实践中心省立医院傅强教授团队设计了一种具有磁靶向能力的工程纳米酶免疫调节剂用于酶级联催化和超声增强铁死亡诱导,最终实现前列腺癌的超声金属免疫治疗。相关成果以“Engineering nanozyme immunomodulator with magnetic targeting effect for cascade-enzyodynamic and ultrasound-reinforced metallo-immunotherapy in prostate carcinoma”为题发表于期刊Nature Communications(IF:14.7)。蒋妍彦教授、傅强教授为本论文的通讯作者,材料学院博士研究生王艳东和医学融合与实践中心硕士研究生李昊东为本文的第一作者,山东大学为第一完成单位和通讯单位。
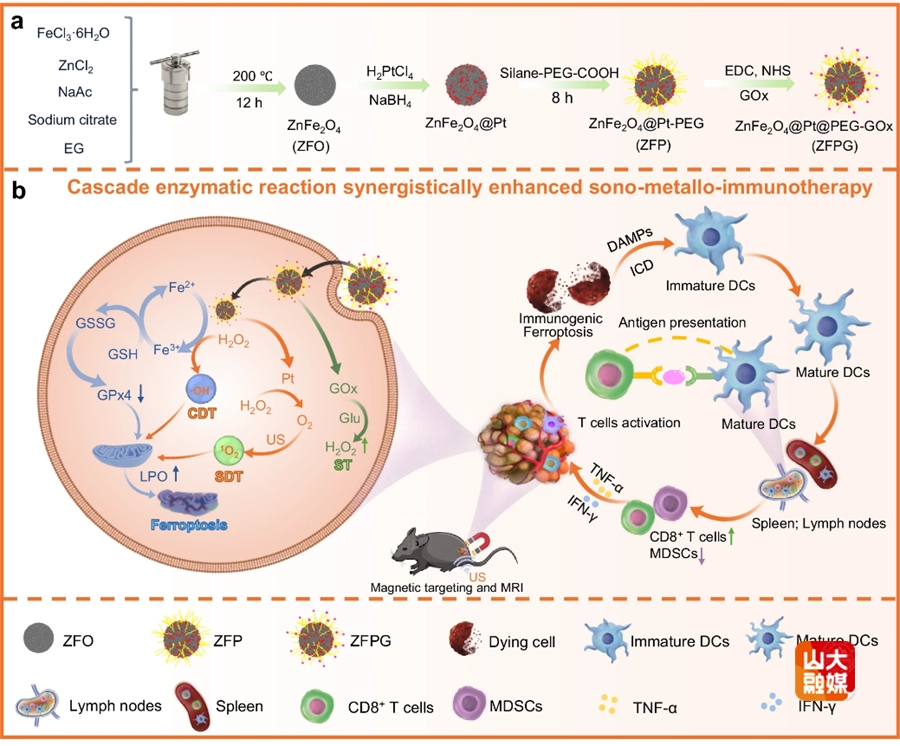
图1. ZFPG纳米酶的制备过程及其用于增强前列腺癌超声金属免疫治疗的作用示意图。
免疫治疗在临床应用中面临着几个严峻挑战,包括低免疫应答率、免疫抑制性肿瘤微环境(TME)和显著的免疫相关不良事件。通过抗癌药物诱导细胞凋亡是引发抗肿瘤免疫治疗反应的一种重要策略。不幸的是,它通常被认为是一种免疫耐受的细胞死亡形式,因为巨噬细胞吞噬凋亡肿瘤细胞可以增强TME内的免疫抑制并防止刺激宿主免疫系统。设计具有类酶活性的纳米酶来诱导肿瘤内部活性氧(ROS)爆发,增强细胞内脂质过氧化物的(LPO)积累,诱导免疫原性铁死亡,为克服免疫抑制TME和增强免疫应答提供了一种新型的策略。然而,TME的高度异质性严重限制了单一酶活性的纳米酶诱导免疫原性铁死亡的能力,通过设计集成多酶活性于一体的纳米酶,实现级联催化反应,有望打破肿瘤稳态并克服TME免疫抑制状态。针对这一难题,研究团队开发了一种具有ZnFe2O4@Pt核心和葡萄糖氧化酶(GOx)壳的ZFPG纳米颗粒(ZFPG NPs)用于前列腺癌的超声金属免疫治疗。ZFPG NPs具有五种酶活性(类过氧化物酶、类过氧化氢酶、类氧化物酶、类谷胱甘肽过氧化物酶和GOx)、良好的声敏性能和显著的磁靶向特性。这项研究为纳米酶的设计和克服传统免疫治疗局限性方面提供了良好的范例(图1)。
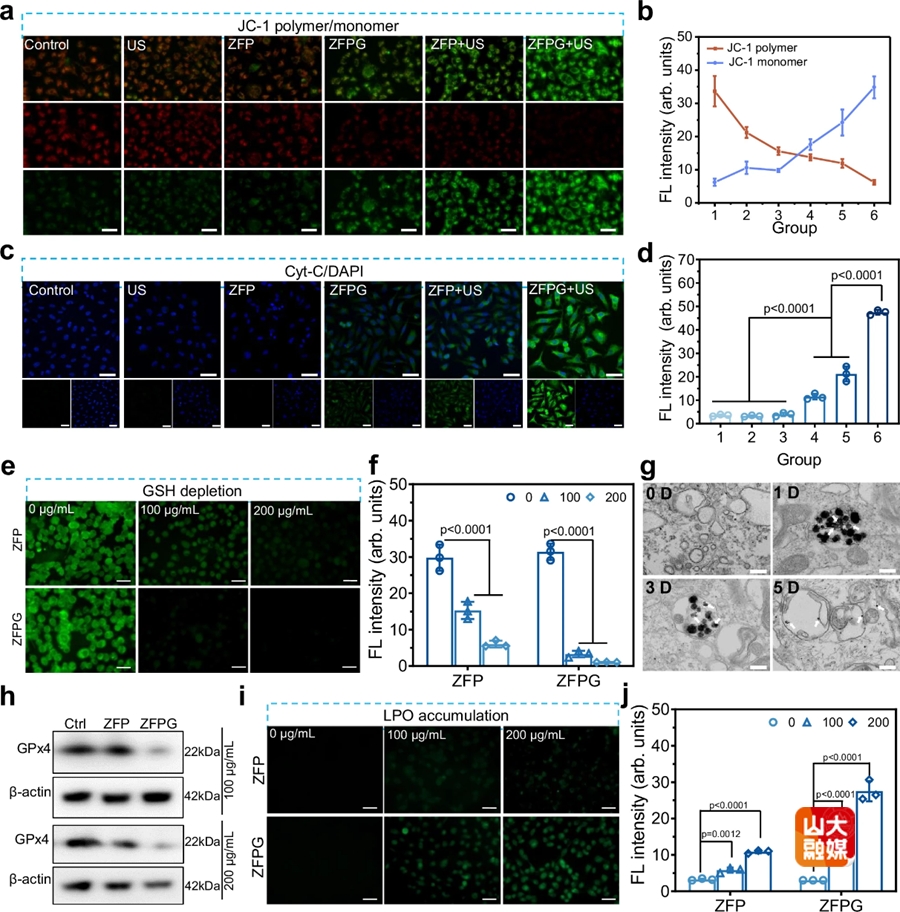
图2.(a)经不同处理后的PC-3细胞的线粒体膜电位变化,比例尺50μm。(b)JC-1聚集体和JC-1单体荧光强度统计。(c-d)经不同处理后的PC-3细胞Cyt-C释放以及荧光强度统计结果,比例尺50μm。(e-f)荧光图像和强度显示与ZFP和ZFPG NPs共孵育24 h的PC-3细胞内的GSH水平,比例尺50μm。(g)ZFPG与PC-3细胞共孵育不同时间点后的bio-TEM图像。(h)与不同浓度的ZFP和ZFPG共孵育后的PC-3细胞的GPx4表达情况。(i-j)荧光图像和强度显示与ZFP和ZFPG NPs共孵育24 h的PC-3细胞内的LPO水平,比例尺50μm。
ZFPG NPs介导的酶级联催化作用展现出强劲的抗癌潜力。具体而言,该作用机制可显著上调细胞内活性氧(ROS)水平,同时诱导细胞内谷胱甘肽(GSH)耗竭,并抑制谷胱甘肽过氧化物酶4(GPx4)的活性,最终促使脂质过氧化物(LPO)在细胞内积累。值得关注的是,ZFPG NPs的GSH响应特性推动ZFPG NPs在肿瘤细胞内快速降解,造成Fe离子过载,有助于进一步提升癌细胞发生铁死亡的效率(图2)。此外,声动力治疗(SDT)与酶动力治疗(EDT)联合治疗手段能够显著诱导多种免疫信号分子的表达或释放,如钙网蛋白(CRT)、高迁移率族蛋白B1(HMGB1)、热休克蛋白90(HSP90)以及三磷酸腺苷(ATP)等。这些免疫信号分子能够增强树突状细胞(DC)的成熟,提升其抗原呈递能力,从而激活机体的免疫系统。
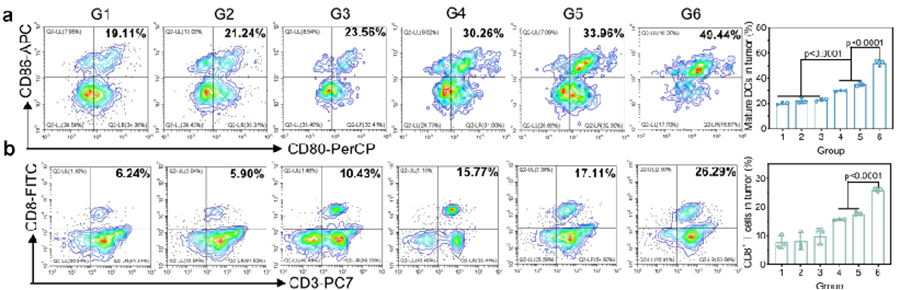
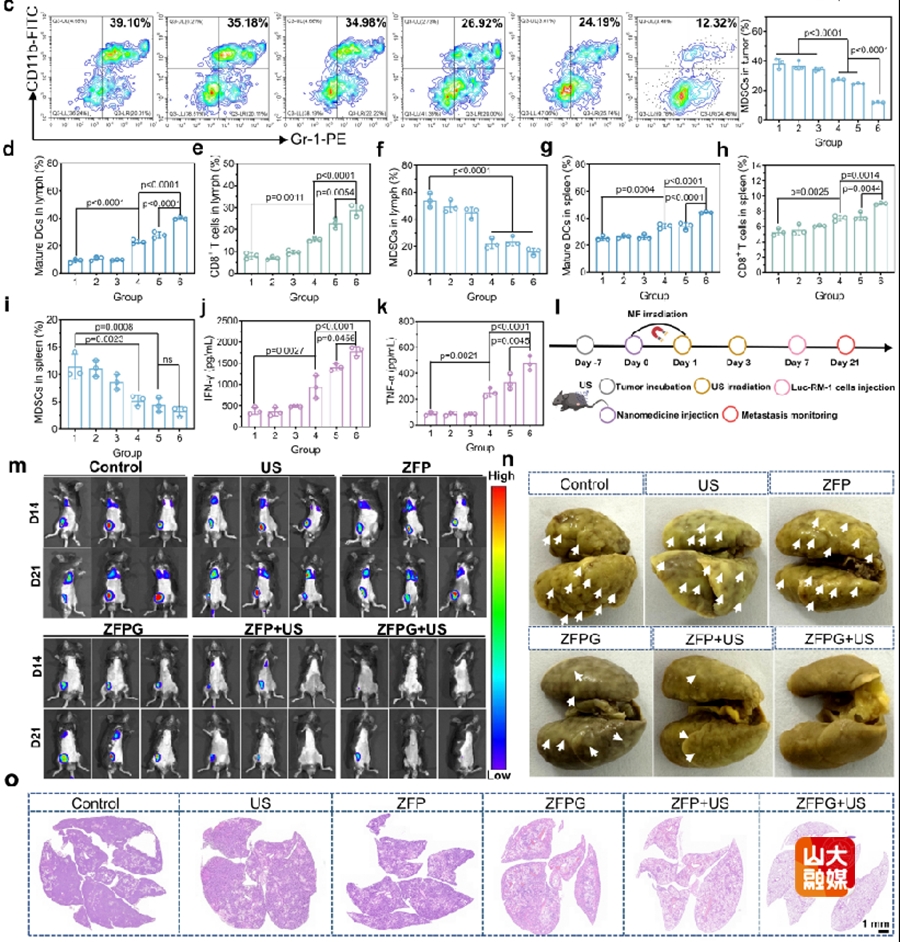
图3.流式细胞术分析经各种治疗后肿瘤中成熟DCs(a)、CD8+ T细胞(b)和MDSCs(c)的数量。经各种治疗后淋巴结中成熟DCs(d)、CD8+ T细胞(e)和MDSCs(f)的数量。经各种治疗后脾脏中成熟DCs(g)、CD8+ T细胞(h)和MDSCs(i)的数量。不同治疗后肿瘤中IFN-γ(j)和TNF-α(k)的水平。(l)前列腺癌肺转移模型的构建及治疗流程示意图。(m)Luc-RM-1荷瘤C57BL/6J雄性黑鼠经不同处理后的体内荧光成像。(n)不同处理后的肺组织经布氏固定液固定后的代表性图像以及(o)经H&E染色后的肺组织切片的代表性图像。
多种小鼠模型实验为ZFPG NPs的治疗效果提供了有力证据。实验结果表明,ZFPG NPs不仅具有良好的磁靶向效果,能够精准定位到肿瘤部位,还能有效激活机体免疫系统。如图3所示,免疫原性细胞死亡与免疫原性铁死亡相结合的治疗策略,可显著诱导DC成熟,同时减少骨髓来源抑制性细胞(MDSCs)向TME的浸润。这一过程有效缓解了TME的免疫抑制状态,为机体免疫系统攻击肿瘤创造了有利条件。在此基础上,CD8⁺ T细胞能够更有效地向肿瘤部位浸润,并释放免疫相关细胞因子,实现对前列腺癌的超声金属免疫治疗。更为关键的是,激活的免疫系统在抑制肿瘤转移方面发挥了积极作用。对于晚期癌症患者而言,肿瘤转移往往是导致病情恶化和预后不良的主要原因。ZFPG NPs激活的免疫系统能够抑制肿瘤向肺部转移,这为晚期癌症的治疗带来了新的希望和治疗思路。
材料学院和医学融合与实践中心在学校医工交叉战略引领下,打造“跨学科导师团队-前沿交叉课题-国家级科研平台”协同机制,系统推进“学科交叉课程建设-科研攻关实践-创新成果转化”全链条培养模式。合作团队在智能诊疗材料、肿瘤靶向治疗等领域产出一批标志性成果,并通过医工联合实验室、临床转化基地等平台培养出兼具材料工程素养与医学应用能力的复合型创新人才。
蒋妍彦教授团队长期致力于纳米酶在抗肿瘤领域的研究。在前期研究工作中,通过精准调控金属活性位点的电子结构和配位环境,成功开发了高效、稳定且具有优异催化性能的纳米酶(Angewandte Chemie International Edition,2022,62,7,e202214042);构建了一系列超声和近红外光等物理场响应的纳米催化协同体系,实现对不同类型癌症的超声免疫治疗和光热-催化协同治疗(ACS Nano,2024,18,7,5828-5846;Advanced Science,2024,11,16,2308316;Acta Biomaterialia,2023,170,496-506;Small,2024,2403861)。此外,金属离子在赋予纳米材料类酶活性、激活免疫和增强抗肿瘤杀伤等方面扮演重要角色,该团队总结了不同金属离子(Fe、Cu、Zn、Mn等)在肿瘤治疗中的作用机制以及增强策略,为后续金属纳米酶的设计提供了新的思路(Coordination Chemistry Reviews,2024,500,215535;Materials Horizons,2024,11,4275-4310)。
上述工作得到了国家自然科学基金和泰山学者专项基金等基金项目资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...