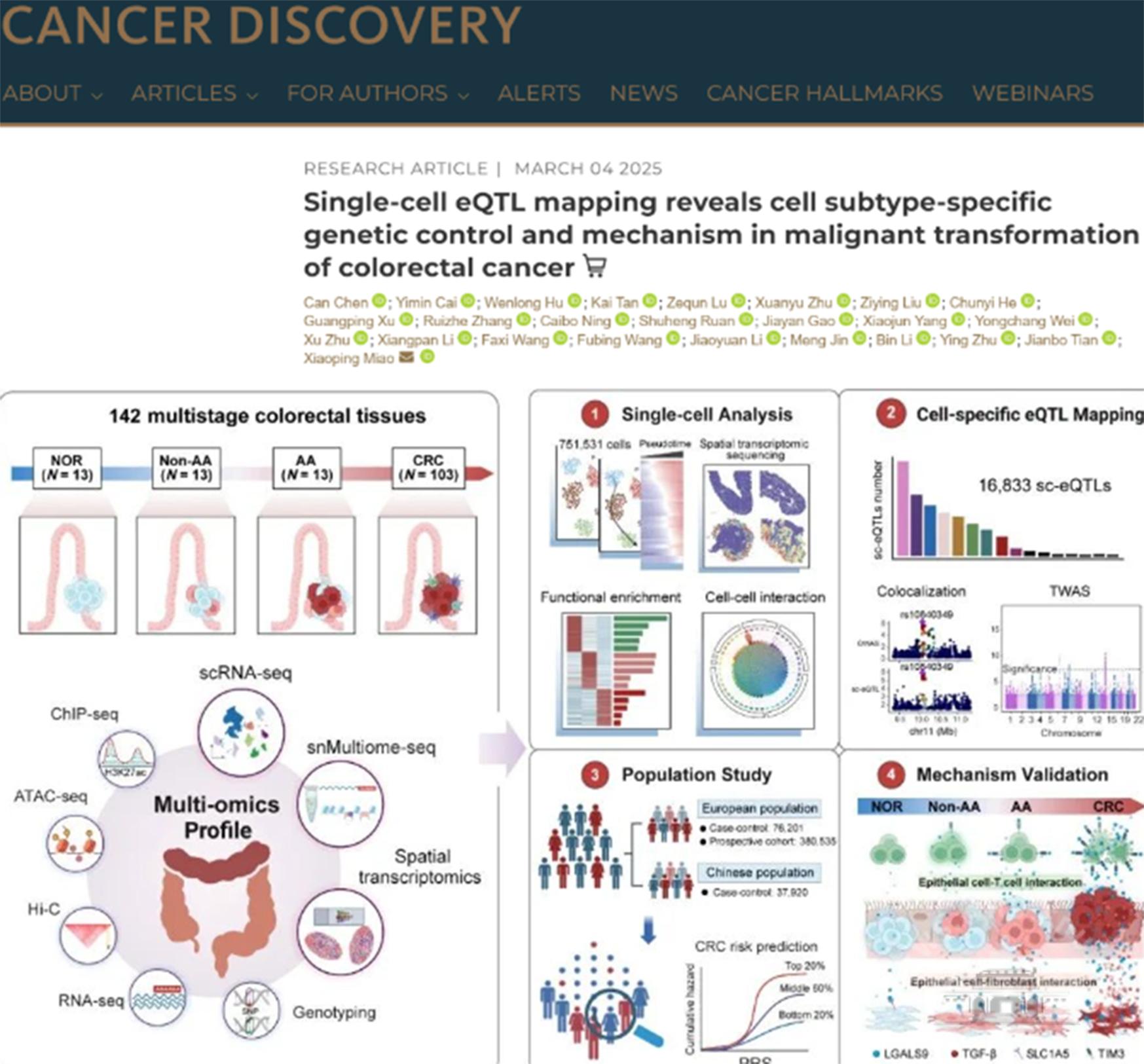
(通讯员樊杰)近日,武汉大学公共卫生学院和泰康生命医学中心缪小平和田剑波教授团队,在肿瘤学刊物Cancer Discovery期刊(IF:29.7)在线发表了题为“Single-cell eQTL mapping reveals cell subtype-specific genetic control and mechanism in malignant transformation of colorectal cancer”原创研究论文。
肿瘤的发生是一个细胞突变逐渐累积、基因-环境互作、染色质表观重塑和肿瘤微环境不断变化的多阶段动态演变的过程。包括作者课题组在内,目前国内外成功鉴定了多个遗传易感位点和表观遗传调控因子等关键分子标志物在结直肠癌发生发展中的作用。然而,这些研究大部分是基于中晚期结直肠癌单个肿瘤阶段,无法从中鉴别出癌症发生早期关键分子特征和分子标志物,尤其是对癌前病变阶段。因此,想要精准鉴定更特异的肿瘤早期分子标志物和分子特征事件,应该把研究关口前沿,重点关注肿瘤早期阶段甚至癌前病变阶段,系统绘制肿瘤全周期的动态演变全景图谱,《“健康中国2030”规划纲要》也提出建立以早期筛查为基础的肿瘤防治策略。
结直肠癌(CRC)是一种典型的多阶段演变肿瘤,其发展经历了从正常组织到癌前病变,包括非进展期腺瘤(non-advanced adenoma,Non-AA)和进展期腺瘤(advanced adenoma,AA),最终转化为癌症的动态演变过程,这一过程为结直肠癌的早期防控提供了绝佳的时间窗口。然而,其动态演变机制仍不清晰,关键节点处早期分子事件尚不明确。因此,我们试图尝试在中国人群中,首次以结直肠癌为突破口系统绘制肿瘤动态演变全景图谱,并在此基础上识别更高效的肿瘤早期分子标志物和潜在干预靶点,构建更加精准化的肿瘤早期筛查方案,最终应用于高危人群识别和结直肠癌的精准防治,是我国当前社会发展和转型中重大健康需求,同样也为其他肿瘤风险预测模型构建和精准早筛提供范式。
遗传异质性是肿瘤异质性的重要来源,也是结直肠癌发展的关键驱动因素。全基因组关联研究(GWAS)已鉴定出超过200个与结直肠癌相关的遗传变异位点,并通过表达数量性状位点(eQTL)策略揭示了其在调控基因表达方面的潜力。然而,现有的基于bulk组织水平的eQTL研究仅能捕捉基因表达的平均信号,无法深入挖掘细胞类型特异性的基因表达调控机制,甚至可能掩盖具有关键功能的调控变异。这一局限性阻碍了我们深入理解遗传变异在细胞类型特异性上如何精密调控基因表达,如何介导肿瘤微环境中细胞互作模式,进而影响肿瘤风险及其潜在分子机制。
为解决上述问题,研究者对来自102名结直肠癌患者的142份多阶段样本,包括正常组织、非进展期腺瘤、进展期腺瘤和结直肠癌组织,开展了单细胞转录组测序(scRNA-seq)、单核多组学测序(snMultiome-seq)和空间转录组(ST)分析,系统刻画了结直肠癌进展过程中细胞异质性,揭示了48种细胞亚群和分子的动态变化。此外,研究者全面绘制了多阶段细胞动态互作网络图谱,发现随着病变的演进细胞间互作愈加频繁且趋向紊乱,同时伴随受体-配体参与的信号通路的演变:从维持组织稳态到炎症免疫反应的调节,再到最终促进肿瘤细胞增殖的转变。为理解结直肠癌的发病机制和早期干预提供了理论依据和潜在分子靶点。
进一步,研究团队首次构建了结直肠癌单细胞表达数量性状位点(sc-eQTL)图谱,涵盖28种细胞亚型中共鉴定16833个sc-eQTL关联对(FDR<0.05)。研究发现,超过76%的sc-eQTL位点具有细胞类型特异性,且能在组织水平eQTL中重复验证的不足15%。凸显了细胞类型特异性的遗传调控在结直肠癌异质性中的关键作用,并更深入挖掘了组织水平上无法鉴定的调控位点。此外,研究者发现sc-eQTL显著富集于结直肠癌GWAS区域内,通过共定位和转录组关联分析(TWAS)整合大规模GWAS-meta结果(纳入888675名参与者),成功识别出传统组织水平分析未能发现的细胞特异性功能易感区域和潜在致病基因。更重要的是,研究团队利用sc-eQTL构建了单细胞水平的多基因风险评分(polygenic risk score,PRS)。在跨种族、多中心的大规模数据集(共447495名参与者)中验证发现,该模型能够有效提升结直肠癌的风险分层能力。其中在团队构建的大规模中国人群病例对照样本中(21874例),高遗传风险组的个体罹患结直肠癌风险相较于低风险组提高了1.34倍。此外,基于sc-eQTL的PRS还能前瞻性预测结直肠癌高危人群,且其预测效能显著优于传统基于GWAS和组织水平eQTL的PRS模型。这一进展说明sc-eQTL不仅能解析肿瘤易感机制,还为结直肠癌的精准预防、早期筛查和高危人群识别策略提供了强有力的支持。
最后,研究者对最显著的单细胞eQTL位点rs4794979,同时是肿瘤上皮细胞特异性的调控位点,进行了进行多种族、多中心的人群流行病学研究(76211例欧洲人群和37920例中国人群)和分子生物学机制深入解读,发现rs4794979-G显著增加中国人群和欧洲人群罹患结直肠癌的风险。进一步的机制实验发现该风险变异能够提高所在增强子区域与转录因子ELK1的结合能力,通过染色质三维折叠远程促进效应基因LGALS9表达。在结直肠癌病变演进过程中,一方面,LGALS9在上皮细胞中的表达呈渐进性升高,与成纤维细胞的SLC1A5交互逐渐增强,导致成纤维细胞的AKT和SMAD2/3等信号通路被激活,促使正常成纤维细胞转变成具有促进癌细胞增殖和恶性表型的癌相关成纤维细胞(cancer-associated fibroblasts,CAFs);另一方面,上皮细胞LGALS9还与CD8+T细胞上抑制性受体TIM3结合,通过LGALS9-TIM3信号轴促进CD8+T细胞耗竭,形成免疫抑制微环境,进而介导肿瘤细胞的免疫逃逸,反映了同一个效应基因在复杂的肿瘤微环境中发挥精密的双重调控效应,最终影响疾病易感性。
该研究系统揭示了结直肠癌在单细胞分辨率下的动态演变过程,首次绘制了细胞类型特异性的遗传调控图谱,并深入解析了其调控结直肠癌多阶段演变的多种细胞互作机制和基因表达调控新模式。为解析结直肠癌的复杂病因和遗传易感新机制提供新的见解,以及肿瘤高危人群识别和早期筛查提供早期分子事件和筛查标志物,助力肿瘤早期筛查和健康中国建设。
(编辑:赵冀帆)
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...