山东大学化学与化工学院前沿化学研究院李春霞教授团队在新型细胞焦亡诱导剂的构建及生物应用领域取得新进展
近日,化学与化工学院前沿化学研究院李春霞教授团队在新型细胞焦亡诱导剂的构建及生物应用领域取得一系列新进展,并在国际期刊Adv. Mater.、Adv. Funct. Mater. 杂志上发表题为“Multifunctional Copper-Phenolic Nanopills Achieve Comprehensive Polyamines Depletion to Provoke Enhanced Pyroptosis and Cuproptosis for Cancer Immunotherapy”“Lysosomal Rupture-Mediated “Broken Window Effect” to Amplify Cuproptosis and Pyroptosis for High-Efficiency Cancer Immunotherapy”的研究性论文(中科院一区TOP),李春霞教授为通讯作者,化学与化工学院博士研究生朱国庆为第一作者,山东大学为第一作者单位。
免疫治疗作为新兴的肿瘤治疗手段备受科学家的青睐,其可以通过激活患者自身免疫系统特异性杀伤肿瘤细胞,但其疗效受限于肿瘤免疫抑制微环境特性及肿瘤细胞的异质性耐药机制。细胞焦亡与铜死亡作为新兴的细胞程序性死亡方式广受关注,其可以诱导肿瘤细胞释放免疫原性信号以重塑肿瘤微环境,增强抗肿瘤免疫反应。并非完美的是,细胞焦亡与铜死亡治疗肿瘤的同时往往带来一定的毒副作用。在此,李春霞教授团队针对提高免疫治疗安全性以及抗肿瘤治疗效果设计了两种增强细胞焦亡与铜死亡的治疗策略来克服这一问题。
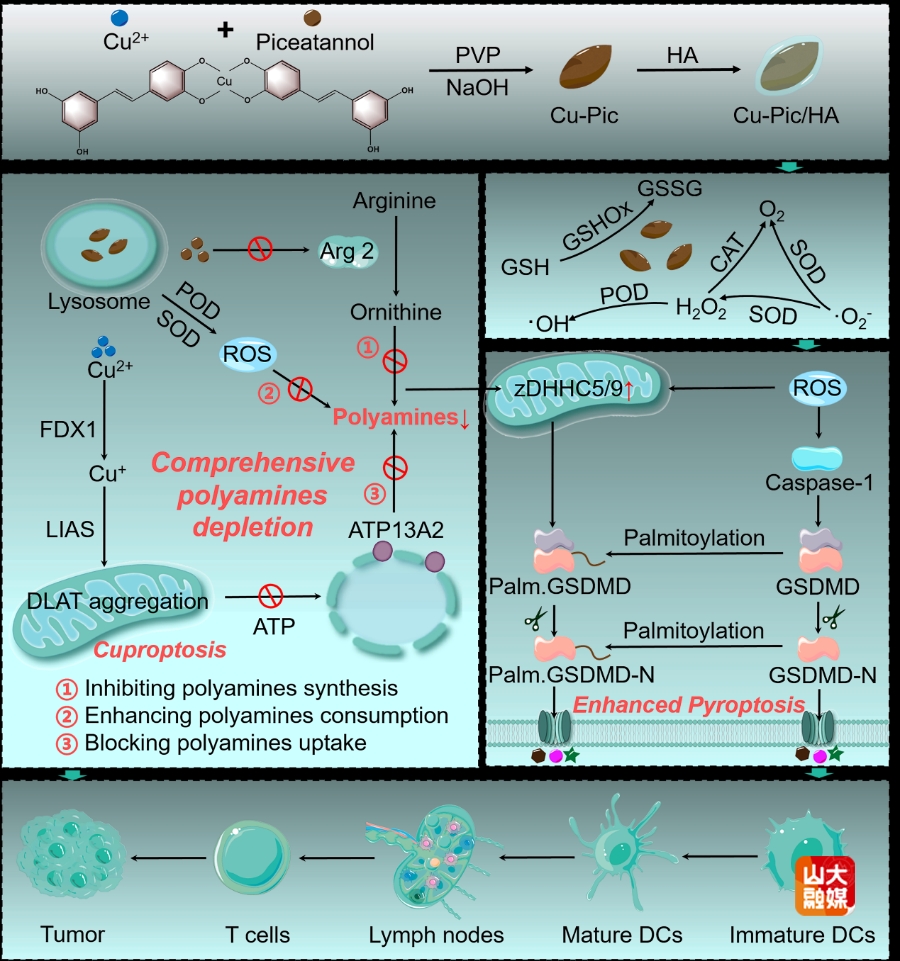
图1 Cu-Pic/HA NPs造成细胞内多胺全面耗竭诱导增强型细胞焦亡与铜死亡应用于抗肿瘤免疫治疗的示意图。
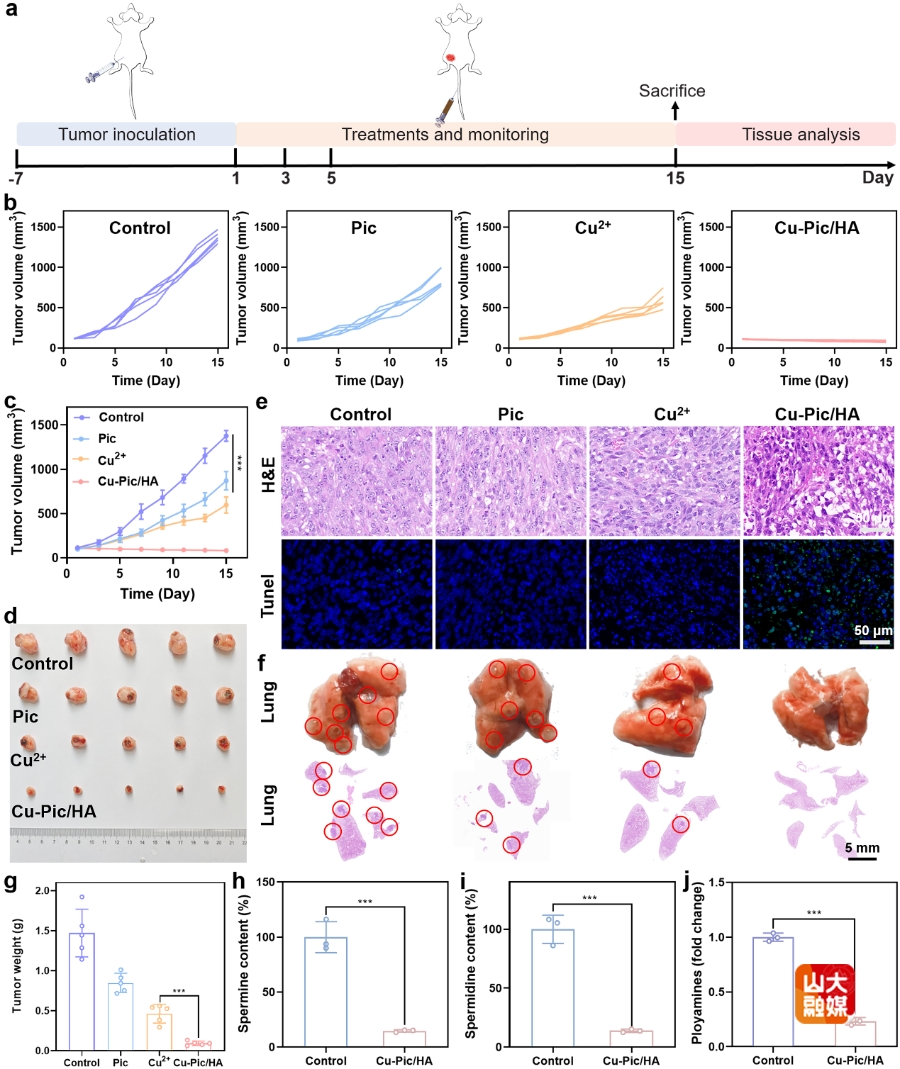
图2 a) 活体抗肿瘤实验过程。b,c) 不同处理后第1天至第15天肿瘤生长曲线。d) 不同处理后的肿瘤图像。e) 不同处理后H&E和TUNEL染色的肿瘤切片。f) 不同处理后H&E染色的肺切片和肺组织照片。g)不同治疗后的肿瘤重量。肿瘤组织中h) 精胺、i) 亚精胺和j) 多胺含量。
(1)细胞内多胺全面耗竭诱导的增强型细胞焦亡和铜死亡:随着对细胞焦亡的持续探究,总结出如何不可逆的调控肿瘤细胞内氧化应激对于诱导细胞焦亡尤为重要。鲜为人知的是,多胺作为肿瘤细胞内大量存在的自由基清除剂广泛参与调控细胞内氧化还原平衡。多胺在肿瘤细胞内高表达带来很多负面影响,如调节基因表达、逃避免疫检测、促进恶性增殖等。基于此,团队设计了一种基于铜、白皮杉醇和透明质酸的多功能纳米颗粒。材料具有类过氧化物酶、类过氧化氢酶、类超氧化物歧化酶与类谷胱甘肽氧化酶等多种酶活性,可以造成产生活性氧从而快速消耗细胞内多胺。另外,白皮杉醇可以有效抑制精氨酸酶2的活性,间接抑制了多胺的合成。材料的酸性降解能力造成溶酶体功能障碍,导致位于溶酶体膜表面的多胺转运蛋白ATP13A2活性降低,使得细胞摄取多胺的能力减弱。因此,通过减少摄取、抑制合成与增强消耗全方位实现了细胞内多胺耗竭。降解释放的铜离子会进入线粒体与硫酰化的二氢硫酰胺s-乙酰转移酶(DLAT)相连造成脂化蛋白聚集诱导铜死亡。炎症小体募集随后裂解焦亡蛋白GSDMD成功诱导细胞焦亡。不仅如此,zDHHC5和zDHHC9表达上调进一步促进GSDMD和GSDMD-N的棕榈酰化,棕榈酰化的GSDMD和GSDMD-N进一步增强细胞焦亡(图1)。如图2所示,增强型细胞焦亡以及铜死亡的发生导致肿瘤相关损伤分子模式(DAMPs)泄漏,有效逆转肿瘤免疫抑制微环境激活体内抗肿瘤免疫反应,具有优异的抗肿瘤治疗效果(Adv. Mater. 2024, 36, 2409066)。
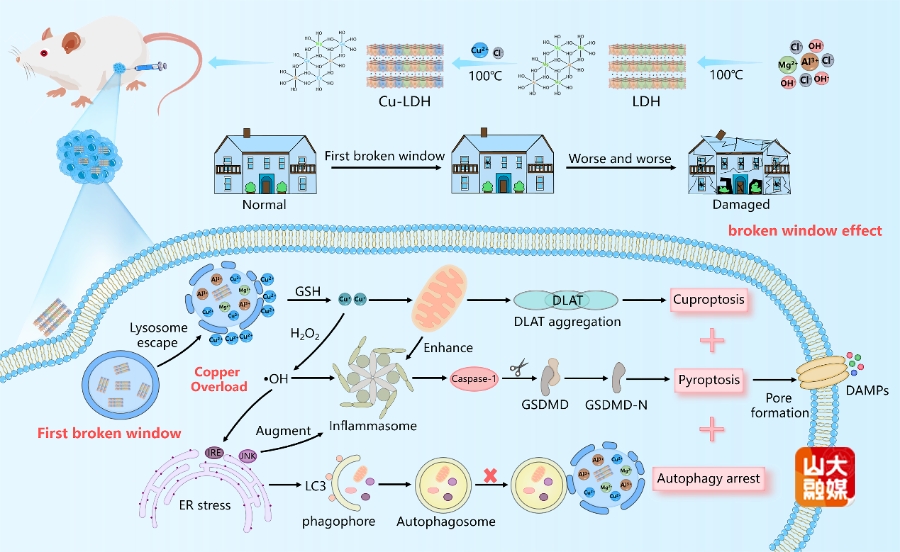
图3 可生物降解的Cu-LDH通过破坏溶酶体抑制细胞自噬增强细胞焦亡与铜死亡。
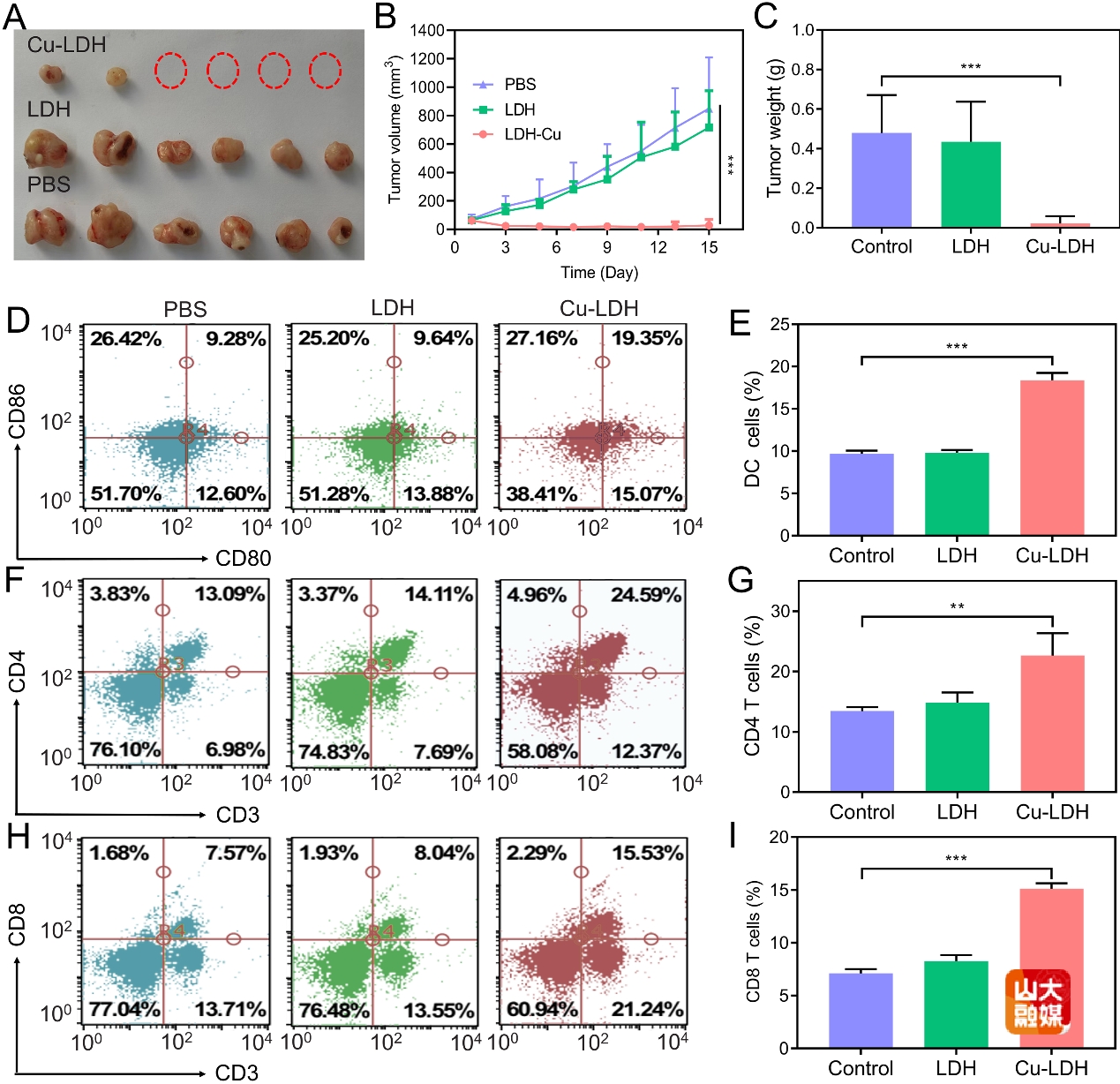
图4 A) 不同处理后小鼠的肿瘤图像。B) 不同处理后小鼠肿瘤体积。C) 不同处理后小鼠肿瘤重量。D) 不同处理后淋巴结中DC细胞的流式数据分析。E) DC细胞数量对比。F) 不同处理后淋巴结CD4+T细胞的流式数据分析。G) CD4+ T细胞数量对比。H) 不同处理后淋巴结CD8+ T细胞的流式数据分析。I) CD8+ T细胞数量。
(2)溶酶体破裂介导的自噬抑制增强细胞焦亡与铜死亡:细胞自噬作为细胞自身一种重要的保护机制,依赖溶酶体的分解能力降解细胞内受损的大分子或细胞器,从而维持正常的生命活动。因此,细胞自噬会影响铜死亡以及细胞焦亡的治疗效果,通过溶酶体介导识别并清除相关毒性蛋白。在此,受“破窗效应”启发,团队设计并合成了一种Cu离子掺杂的层状双氢氧化物(Cu-LDH)作为溶酶体破坏剂,诱导Cu离子过量介导的铜死亡和细胞焦亡用于癌症的高效免疫治疗(图3)。Cu-LDH被肿瘤细胞内化首先进入溶酶体。酸性条件使Cu-LDH降解,释放出大量的铜离子,导致溶酶体破裂(作为第一个破窗)。溶酶体破裂导致自噬过程被阻断,因为在自噬过程中自噬溶酶体的形成受到影响,无法发挥正常功能。自噬抑制的发生对后续的铜死亡以及细胞焦亡起到增强的作用。一方面是,部分铜离子会进入线粒体,连接硫酰化二氢硫代酰胺S-乙酰转移酶(DLAT)诱导脂酰化蛋白聚集,诱导铜死亡。另一方面,铜离子通过芬顿反应增加细胞质中活性氧的水平,诱导细胞焦亡。如图4所示,可生物降解的Cu-LDH不仅具备良好的生物安全性,还可以引发强烈的抗肿瘤免疫反应,高效抑制肿瘤生长(Adv. Funct. Mater. 2024, 34, 2400496)。
近年来,李春霞教授团队先后开发了不同新型细胞焦亡以及铜死亡诱导剂(Angew. Chem. Int. Ed. 2022, 61, e202204904;Adv. Mater. 2024, 36, 2308241;Adv. Funct. Mater. 2024, 34, 2400496;Adv. Mater. 2024, 36, 2409066;J. Control. Release 2024, 370, 438;Nano Today 2025, 61, 102640),这些创新不仅揭示了细胞死亡的新机制,还打开了免疫治疗的全新维度。上述工作得到了国家自然科学基金原创探索延续资助项目、面上项目等多个项目资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...