山东大学化学与化工学院前沿化学研究院李春霞教授团队在抑制肿瘤转移方面取得系列进展
近日,化学与化工学院前沿化学研究院李春霞教授团队在抑制肿瘤转移的研究取得一系列新进展,并在国际期刊Angew. Chem. Int. Ed.以及Adv. Funct. Mater.杂志上发表了题为“A Metal Chelation Therapy to Effectively Eliminate Breast Cancer and Intratumor Bacteria While Suppressing Tumor Metastasis by Copper Depletion and Zinc Ions Surge”(被选为“Hot Paper”)以及“Fucoidan-Modified Au Nanocups With Tumor Targeting Inhibits CD24-Mediated Immune Escape and Epithelial Mesenchymal Transition Through Precise Controlled Release of Anti-CD24 Antibodies”的研究性论文(中科院一区TOP),李春霞教授为通讯作者,化学与化工学院博士研究生解玉林为第一作者,山东大学为第一作者单位。
肿瘤转移是导致患者的五年生存率低的主要原因之一。然而,目前临床上对于肿瘤的转移也是束手无策,缺乏行之有效的治疗方法抑制肿瘤的转移。在此,李春霞教授团队从肿瘤转移的起点-上皮间质转化过程(EMT)出发,探索有效抑制肿瘤转移的治疗方法。EMT是肿瘤转移的初始步骤,在促进肿瘤转移中起着关键作用。李春霞教授团队针对肿瘤自身及瘤内菌群设计了两种策略来克服这一问题。
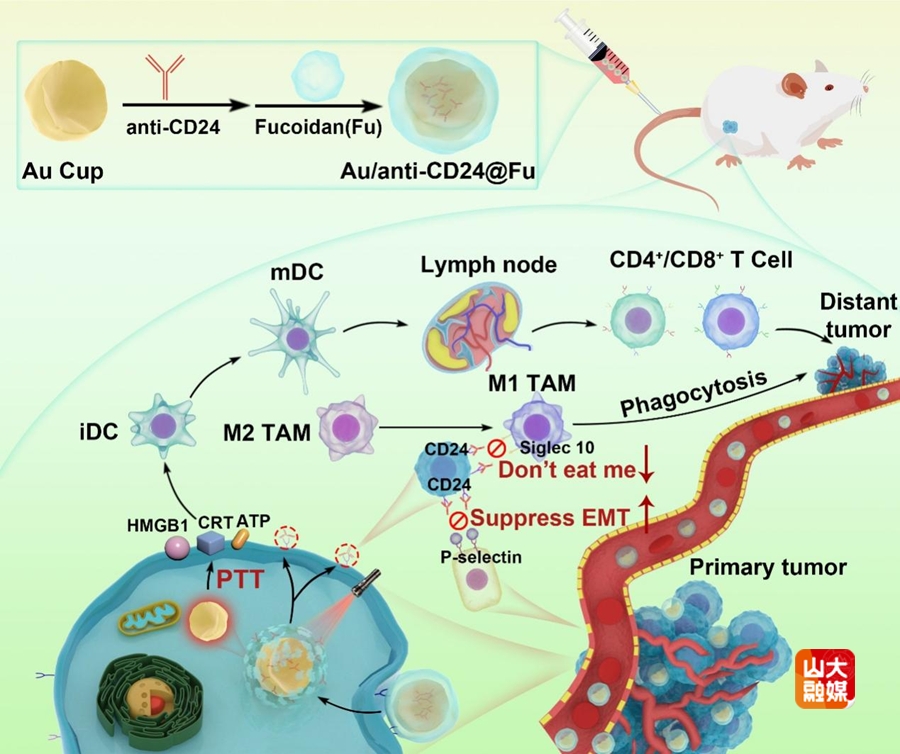
图1 Au/anti-CD24@Fu的构建及抑制肿瘤转移的示意图。
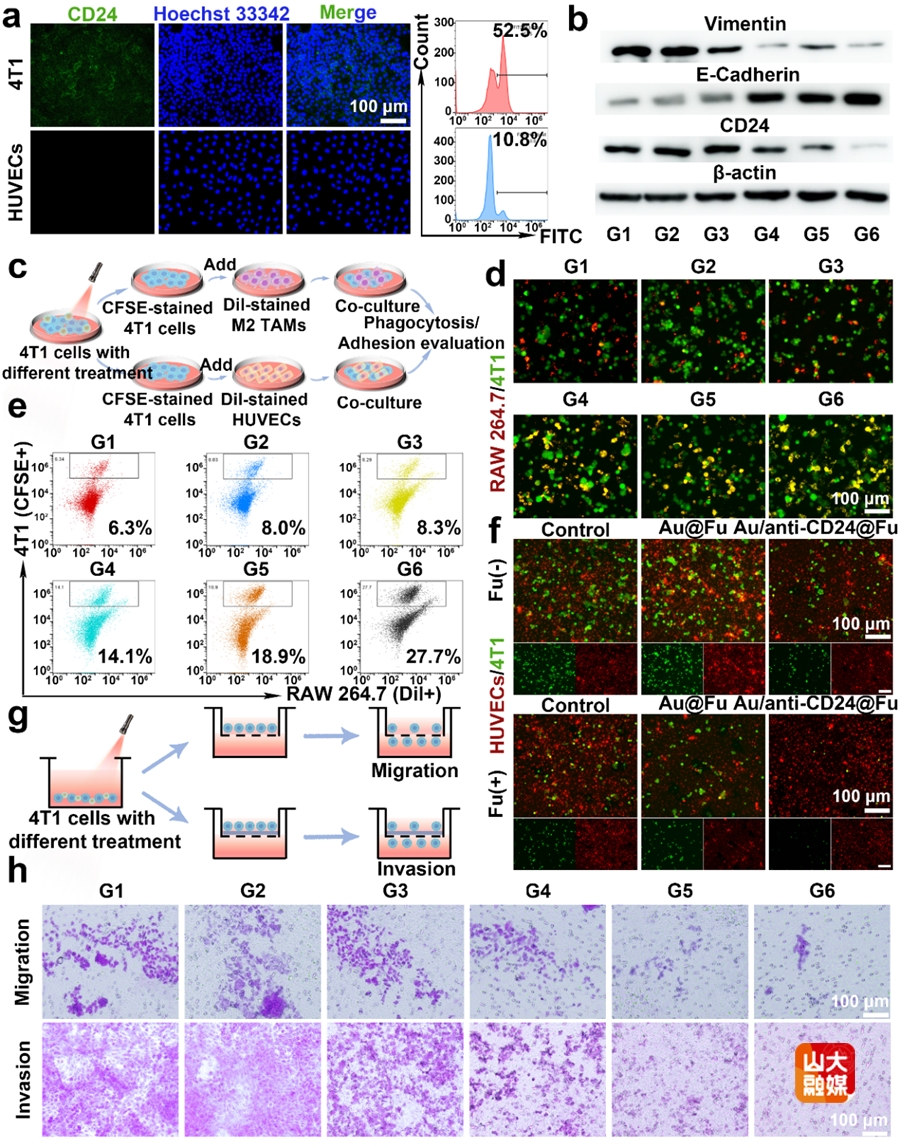
图2 体外抑制肿瘤细胞转移和侵袭的评估。(a)4T1和HUVECs细胞的免疫荧光染色和流式细胞分析。不同治疗后,4T1细胞中CD24、E-钙粘蛋白和波形蛋白的表达情况(b),4T1细胞与巨噬细胞和HUVECs细胞作用的示意图(c),巨噬细胞吞噬4T1细胞的荧光图像(d)以及流式细胞分析(e)。(f)不同处理后,4T1与HUVECs细胞的细胞粘附的荧光图像。评估4T1细胞迁移和侵袭能力的实验示意图(g)以及不同处理后的效果(h)。
(1)阻断CD24功能增强巨噬细胞介导的免疫反应和抑制EMT过程。CD24-Siglec 10信号轴有利于肿瘤逃避巨噬细胞的识别和吞噬。同时,CD24-p-选择素信号轴介导肿瘤细胞向血管转移的EMT过程。目前,对于CD24的研究主要集中在其作为免疫检查点的功能上,而尚未探索干扰CD24功能抑制EMT的过程。基于此,该团队设计具有大孔的Au-Cup纳米杯来递送anti-CD24抗体,以研究阻断CD24功能对于免疫反应和肿瘤转移的影响。如图1所示,Au-Cup表面修饰的岩藻多糖(Fu)赋予其靶向肿瘤及其附近血管的能力,有利于anti-CD24抗体的精准递送。Au-Cup本身的光热特性可以控制anti-CD24抗体的释放。这一设计实现了anti-CD24抗体在肿瘤部位的精准可控释放并抑制了肿瘤的EMT过程以及削弱了其与内皮细胞的粘附。Au/anti-CD24@Fu在携带4T1的小鼠模型和患者来源的异种移植物(PDX)模型中均表现出良好的抗肿瘤和抗转移作用(Adv. Funct. Mater. 2025, 35, 2415120)。
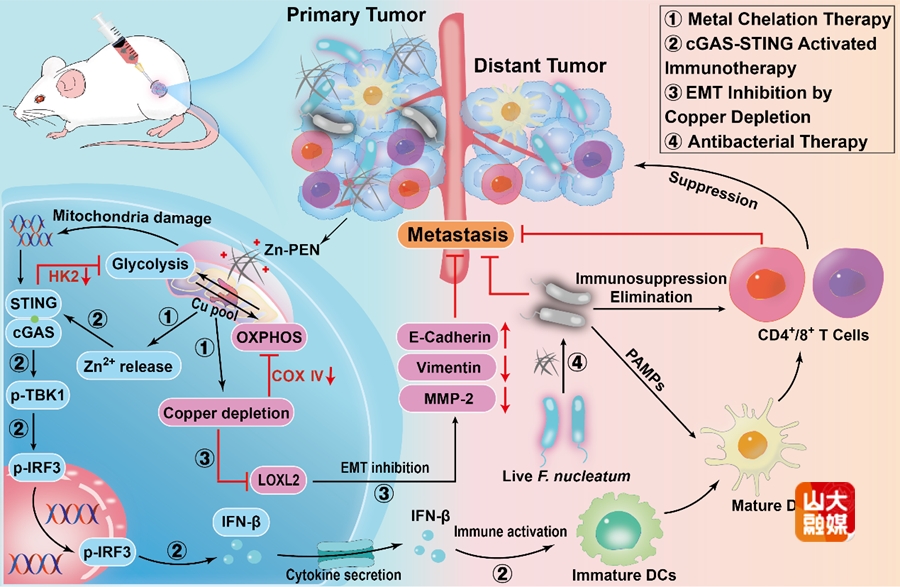
图3 Zn-PEN实现抗肿瘤、抗菌和抗转移效果的机制示意图。
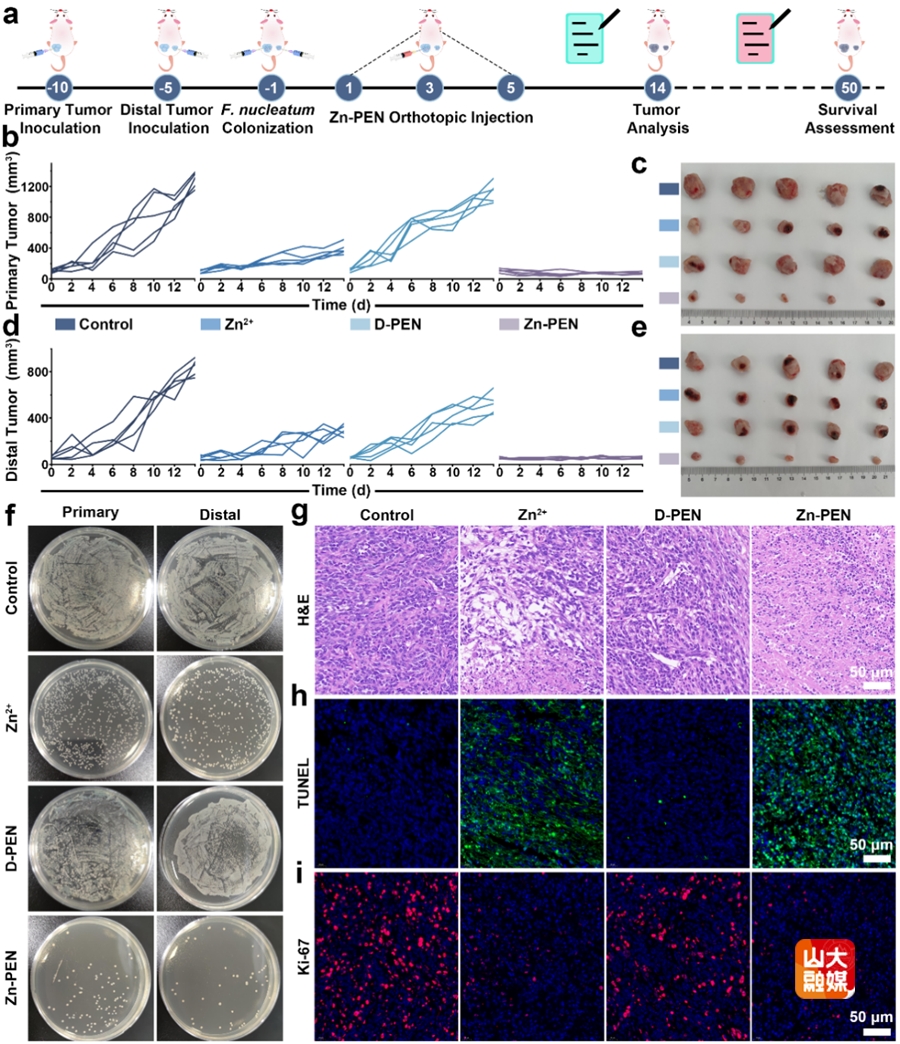
图4 体内抗肿瘤和抗菌效果评估。(a)体内抗肿瘤和抗菌治疗的示意图。(b-e)不同治疗后,原发肿瘤和远端肿瘤的生长曲线以及肿瘤图像。(f)不同治疗14天后,原发肿瘤和远端肿瘤的细菌涂板。不同治疗组小鼠原发肿瘤的H&E(g),TUNEL(h)和 Ki-67(i)染色图像。
(2)提出了金属螯合治疗的新型肿瘤治疗策略。具核梭杆菌(F. nucleatum)是一种口腔厌氧菌,其在乳腺癌中定植,并通过阻碍免疫细胞的浸润从而促进乳腺癌的生长和转移。目前,针对瘤内细菌的所使用的抗生素或抗菌金属离子的策略面临着细菌耐药性和正常组织损伤的困境。该团队提出了一种新的金属螯合疗法,其实现了对肿瘤和瘤内细菌的生长抑制,并通过阻断EMT抑制肿瘤的转移。基于乳腺癌对于铜的高需求,铜螯合剂D-青霉胺(D-PEN)与Zn2+螯合配位形成的纳米治疗剂(Zn-PEN)在肿瘤细胞内可以螯合铜并释放Zn2+,抑制了肿瘤和瘤内细菌的生长(图3)。同时,铜耗竭抑制了赖氨酰氧化酶2(LOXL2)介导的EMT过程,阻断了肿瘤的转移。传统的静脉注射螯合剂的螯合治疗只能消除宿主体内超载的金属离子,而且螯合剂的靶向性差,容易引起全身毒性。该团队提出的金属螯合疗法与传统的螯合疗法完全不同,它不仅消耗了肿瘤生长所必需的金属元素(Cu),而且引入了具有抗肿瘤和抗菌性能的新型金属离子(Zn2+),避免了全身毒性。如图4所示,Zn-PEN介导的金属螯合治疗具有抗肿瘤,抗菌和抗转移作用的协同治疗,为乳腺癌和肿瘤内微生物群的治疗提供了新的见解(Hot Paper, Angew. Chem. Int. Ed. 2025, 64, e202417592)。
上述研究成果拓展了抑制肿瘤转移的治疗策略,为深入了解肿瘤转移过程打下坚实的基础。此外,所提出的金属螯合疗法不仅适用于乳腺癌,而且其对于其它类型的癌症治疗也具有潜在的应用价值。上述工作得到了国家自然科学基金原创探索延续资助项目、面上项目等多个项目资助。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...