近年来,研究人员发现通过人体免疫系统来对抗癌细胞(即癌症免疫疗法)效果显著。其中以免疫检查点程序性死亡受体及其配体(PD-1/PD-L1)阻断疗法最为常见。PD-1,就像是T细胞上的“刹车踏板”。当它与肿瘤细胞表面的PD-L1“握手”时,就像是踩下了刹车,让T细胞的杀伤力瞬间减弱。这种相互作用,就像是给T细胞的攻击行动按下了停止键,让肿瘤细胞得以逃脱免疫系统的杀伤。虽然该疗法起到了一定的进展,现实情况却是,很多患者治疗后会出现T细胞无法有效进入肿瘤、产生耐药性,或者多个免疫检查点之间相互干扰,导致只有少数人真正受益。研究发现,同时阻断多个免疫检查点效果更好。另一个重要的免疫检查点为CD47蛋白,癌细胞会通过表面的CD47蛋白与免疫细胞上的SIRPα蛋白”握手”,伪装成正常细胞不被吞噬。当PD-L1和CD47这两个免疫检查点同时起作用时,癌细胞就能成功逃脱免疫细胞的杀伤。因此同时阻断这两个检查点,成为激活全身抗癌免疫的关键。虽然现在有能同时阻断两个靶点的双抗药物,但这些药物可能引发过度免疫反应(如高烧、器官损伤等严重副作用),而且制作的技术壁垒较高、成本较高。这促使科学家们正在研发更安全、更容易制造的纳米级新型药物,希望既能精准打击癌细胞,又不会误伤正常细胞
基于此,我校刘震教授团队最新发展出一种“智能双靶点纳米药物”,能够精准破解癌细胞对免疫系统的双重伪装。这种药物采用仿生智能识别技术,像两把特制钥匙同时锁住癌细胞表面的PD-L1蛋白和免疫细胞上的SIRPα蛋白。当药物同时黏附这两个关键靶点时,既能阻止癌细胞用PD-L1分子让免疫T细胞“休眠”,又能切断癌细胞通过CD47分子欺骗巨噬细胞的逃生通道。这样一来,免疫系统被全面激活,巨噬细胞化身“清道夫”高效吞噬癌细胞,同时被唤醒的T细胞如同“精准导弹”发起肿瘤消灭战。这种仿生纳米药物不仅为实体瘤治疗开辟了新路径,更开创了多靶点协同免疫治疗的新模式,展现了生物工程技术在癌症治疗中的革新潜力。
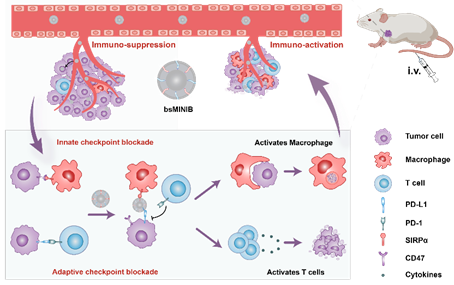
图1. 双特异性bsMINIB阻断双重免疫检查点(ICB)的示意图
相关成果以“Rationally Engineered Bispecific Nanoimmunoblocker Restores Anticancer Immunity via Dual Immune Checkpoint Blockade”为题,发表于ACS Nano上。我校化学化工学院刘震教授为文章的通讯作者,博士生官佩鑫为文章的第一作者。该研究受到国家自然科学基金重点资助(21834003)和南京大学卓越计划(ZYJH004)等的支持。
论文链接:
https://pubs.acs.org/doi/full/10.1021/acsnano.4c13463
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...