中山大学白莹副教授团队提出基于脱细胞基质微凝胶载体及预孵育技术的新型干细胞移植策略
创伤性脊髓损伤可导致脊髓神经元的大量死亡,严重的会使患者完全丧失运动和感觉功能,造成受损节段以下完全瘫痪。神经干细胞移植一直被认为是一种可行的脊髓损伤细胞疗法,可有效补充受损死亡的神经元并重建神经网络。然而,由于移植干细胞极低的存活率和体内分化方向不受控制等突出问题,直接将未成熟的神经干细胞注射到损伤部位后,脊髓神经再生和功能恢复效果并不理想。
针对脊髓损伤细胞移植疗法中的痛点问题,材料科学与工程学院白莹副教授团队提出了一种利用天然脊髓组织来源的脱细胞基质微凝胶作为神经干/祖细胞(Neural stem/progenitor cells, NSPCs)移植载体,通过体外预分化和微创原位注射方式对严重的脊髓挫伤疾病模型进行细胞治疗。由于该脱细胞基质微凝胶具有脊髓组织特异性的生物活性,可在体外促进NSPCs向神经元分化,并在移植后通过改善脊髓损伤微环境募集内源性干细胞,实现细胞移植疗法与内源性修复再生的协同作用。这种原位细胞治疗方法成功提高了移植NSPCs用于脊髓损伤治疗的术后效果,具有极强的临床转化潜力。
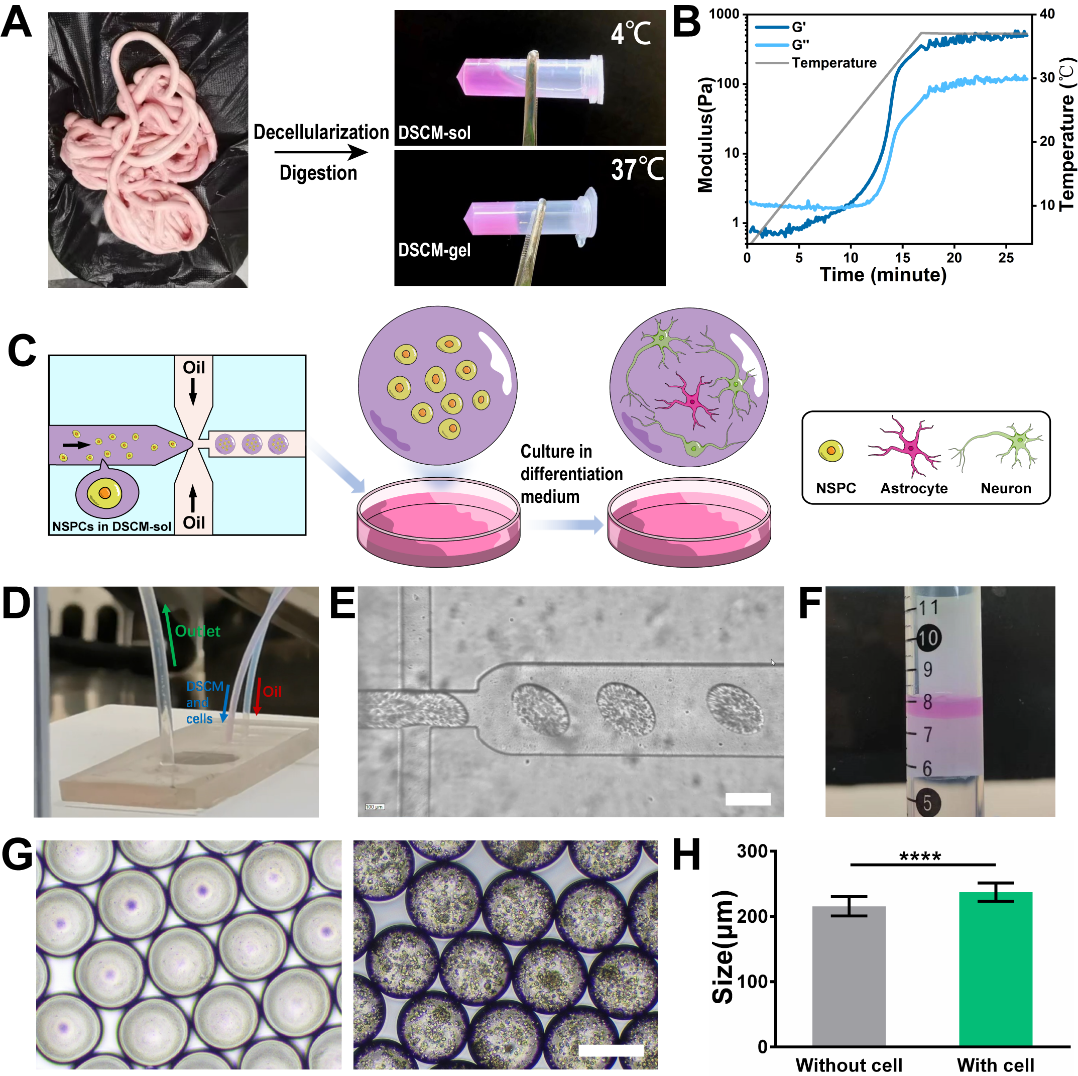
图1. NSPC@DSCM-MGs的制备过程
首先,本研究使用自主搭建的微流控系统将NSPCs封装在脊髓来源脱细胞基质微凝胶(DSCM-MGs)中,成功获得了负载NSPCs的脱细胞基质微凝胶(NSPC@DSCM-MGs),并在体外对其进行神经元向分化诱导。结果证明, NSPC@DSCM-MGs 中三维孵育的NSPCs在七天内大部分向神经元而非星形胶质细胞分化。该结果同时表明基于微凝胶的三维培养体系,相比于传统的大块水凝胶三维培养,可以更加明显地提高NSPCs向神经元分化的效率。
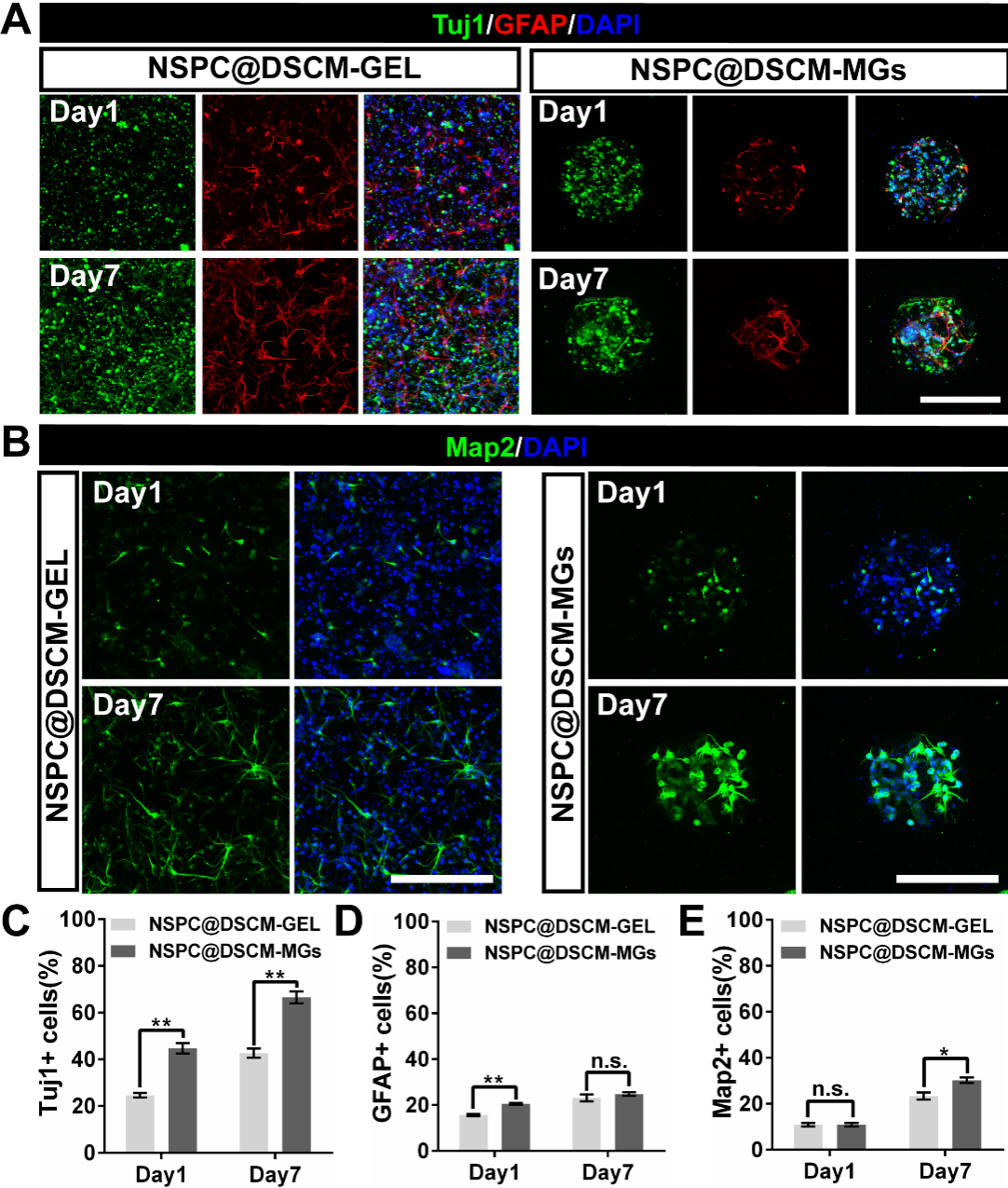
图2. NSPC@DSCM-MGs在体外预孵育可促进NSPCs向神经元分化
将经诱导分化预孵育NSPC@DSCM-MGs产生的3D神经球注射到严重挫伤的大鼠脊髓模型中,发现脱细胞基质微凝胶可有效保护移植细胞,免受剪切损伤和病变部位炎症微环境的损伤,显著提高了外源性细胞的存活率。此外,NSPC@DSCM-MGs在体内提高了移植的以及募集的内源性NSPCs向神经元分化的效率,有效补充了脊髓损伤后损失的神经元数量,抑制了胶质瘢痕的形成。此外,大量存活的预分化NSPC@DSCM-MGs积极调节损伤部位微环境,促进内源性细胞募集、轴突再生和神经网络重建,并帮助维持脊髓组织结构的完整性,促进了严重脊髓挫伤大鼠的运动功能恢复。
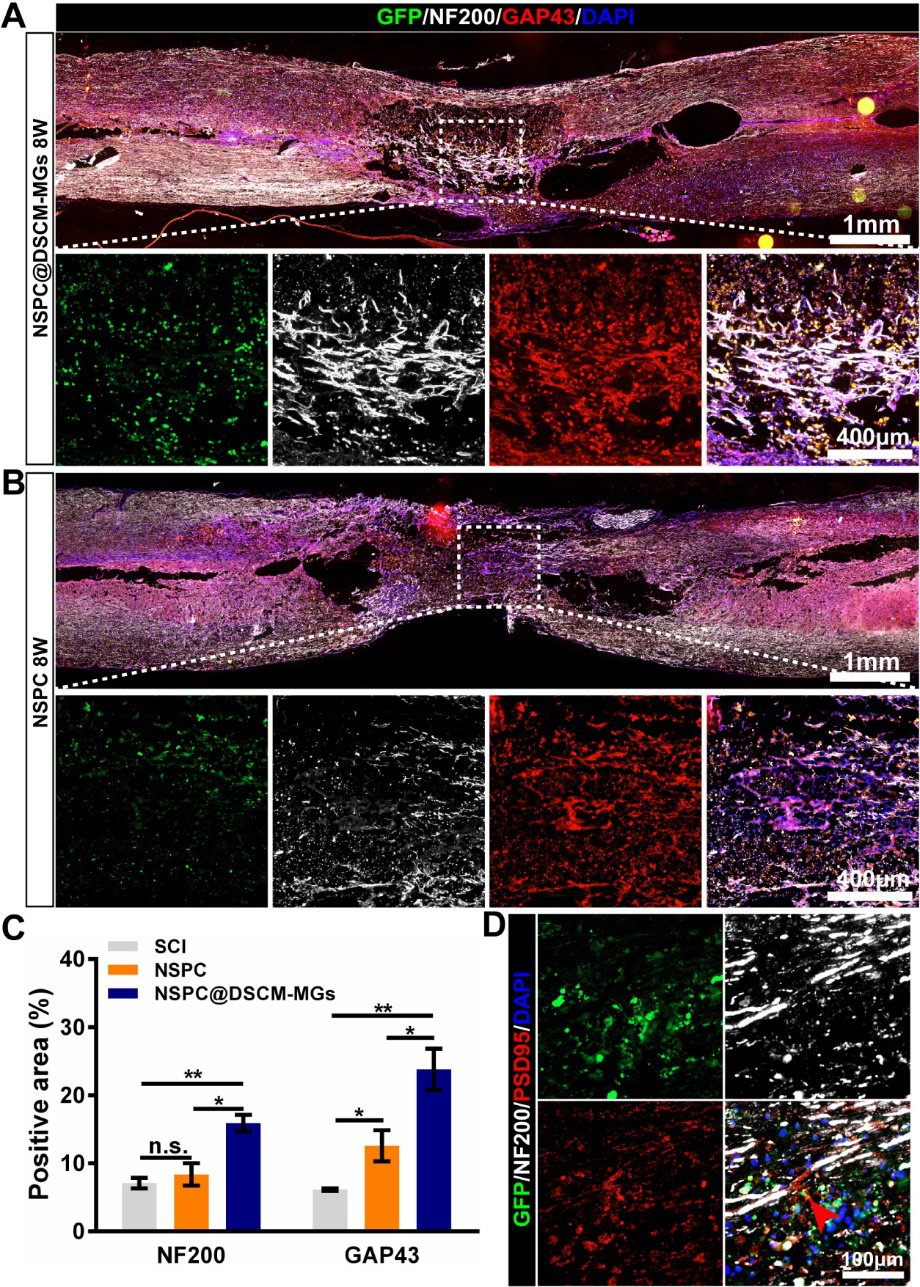
图3. 移植的NSPC@DSCM-MGs在体内促进轴突再生和神经网络重建
综上所述,这种基于脱细胞基质微凝胶载体及预孵育技术的新型干细胞移植策略,在细胞保护和细胞命运调控方面显示出独特的优势,通过内源性和外源性细胞的协同作用有效促进受损脊髓的再生修复。该方法在组织工程和再生医学领域的临床应用中具有极大前景,并且有希望扩展应用于其他疾病的治疗中。
该工作于2024年6月20日以“Transplantation of Pre-Differentiated 3D Neural Spheroids in Decellularized Extracellular Matrix Microgels Promotes Neuronal Network Reconstruction and Functional Recovery after Severe Spinal Cord Contusion”为题在线发表于国际知名学术期刊Advanced Functional Materials上(DOI:10.1002/adfm.202407097)。材料科学与工程学院21级硕士研究生张可鑫(排名第一)和博士后饶子龙为该论文共同第一作者,白莹副教授为唯一通讯作者,材料科学与工程学院为论文第一单位。该研究工作受到国家自然科学基金、广东省基础与应用基础研究基金等项目的大力支持。
© 版权声明
本文由分享者转载或发布,内容仅供学习和交流,版权归原文作者所有。如有侵权,请留言联系更正或删除。
相关文章

暂无评论...